پwƒRƒŒƒ‰“إ‘f‚جچ\‘¢‚ئ‹@”\‚ً•S“ْٹP“إ‘f‚ئ‚ً”نٹr‚µ‚ؤڈq‚ׂوپx
‚fپ|‚P‚O
98087
ژRچè‚ ‚ن‚ق 98091 ‹gœAچ„98088
‹g‰ھژj—² 98092 ‹g‘؛چپ—¢98089
‹gگىکa•F 98093 •ؤ‘q’¼”ü98090
‹g•گڈGˆêکY 98094 “n•س‘ڈ98095
“n•”گ^Œلپ@
پs
G.I.O.پt‰u•a‚ئ‚¢‚¤‚à‚ج‚ح‚¢‚آ‚جژ‘م‚àڈêڈٹ‚ً–â‚ي‚¸پAڈي‚ة‚ي‚ê‚ي‚ê‚جگ¶ٹˆ‚ً‹؛‚©‚µ‘±‚¯‚ؤ‚¢‚éپB’†گ¢ƒˆپ[ƒچƒbƒp‚ة‚¨‚¯‚éƒyƒXƒg‚ج‘ه—¬چs‚âپA“ْ–{‚إ‚àچ]Œث––ٹْ‚ة‚¨‚¯‚邱‚ê‚ç‚ج‘ه—¬چs‚ب‚اپAگlٹش‚جگ¶–½‚ًچإ‚à‘½‚’D‚ء‚ؤ‚¢‚é‚ج‚ح•گٹي‚إ‚ح‚ب‚پA‚±‚ê‚ç‚ج“إ‘f‚ً•ْڈo‚·‚éچ׋غ‚إ‚ ‚é‚©‚ج‚و‚¤‚ة‚àٹ´‚¶‚ç‚ê‚éپB‚»‚±‚إ‰نپX‚حپA‚»‚ê‚ç‚ج“إ‘fپA‚¨‚و‚رچ׋غ‚ة‚آ‚¢‚ؤ‚ج—‰ً‚ًگ[‚كپAڈ«—ˆ‚جˆم—أٹˆ“®‚ة–ً—§‚ؤ‚½‚¢‚ئچl‚¦‚ؤ‚¢‚éپB
پ@
پs
S.B.O.پt‚PپDƒRƒŒƒ‰“إ‘fپA‚¨‚و‚ر•S“ْٹP“إ‘f‚ھ”Œ©‚³‚ê‚é‚ةژٹ‚ء‚½—ًژj“I”wŒi‚ة‚آ‚¢‚ؤگà
–¾‚إ‚«‚éپB
‚QپDƒRƒŒƒ‰‹غ‚جچ\‘¢‚ة‚آ‚¢‚ؤگà–¾‚إ‚«‚éپB
‚RپD•S“ْٹP‹غ‚جچ\‘¢‚ة‚آ‚¢‚ؤگà–¾‚إ‚«‚éپB
‚SپDƒRƒŒƒ‰“إ‘f‚ج‰»ٹw“Iچ\‘¢پA‚¨‚و‚ر‚»‚جƒŒƒZƒvƒ^پ[‚ة‚آ‚¢‚ؤگà–¾‚إ‚«‚éپB
‚TپD•S“ْٹP“إ‘f‚ج‰»ٹw“Iچ\‘¢پA‚¨‚و‚ر‚»‚جƒŒƒZƒvƒ^پ[‚ة‚آ‚¢‚ؤگà–¾‚إ‚«‚éپB
‚UپDƒRƒŒƒ‰“إ‘f‚جژYگ¶‚ج‚³‚ê•ûپA‚¨‚و‚ر‚»‚ج•ْڈo‚ج‰ك’ِ‚ًگà–¾‚إ‚«‚éپB
‚VپD•S“ْٹP“إ‘f‚جژYگ¶‚ج‚³‚ê•û‚ئ‚»‚ج•ْڈo‚ج‰ك’ِ‚ة‚آ‚¢‚ؤگà–¾‚إ‚«‚éپB
‚WپDƒRƒŒƒ‰“إ‘fپA‚¨‚و‚ر•S“ْٹP“إ‘f‚ج‘ٹˆل“_‚ة‚آ‚¢‚ؤ‹ï‘ج“I‚ةڈq‚ׂ邱‚ئ‚ھ‚إ‚«‚éپB
‚XپDƒRƒŒƒ‰“إ‘fپA‚¨‚و‚ر•S“ْٹP“إ‘f‚جچ\‘¢‚ً“¥‚ـ‚¦‚½ڈم‚إپA‚±‚ê‚ç‚ج“إ‘f‚ھگl‘ج‚ة‹y
‚ع‚·ڈاڈَ‚ة‚آ‚¢‚ؤگà–¾‚إ‚«‚éپB
‚P‚OپDƒRƒŒƒ‰“إ‘fپA‚¨‚و‚ر•S“ْٹP“إ‘f‚جچ\‘¢‚ً“¥‚ـ‚¦‚½ڈم‚إپA‚±‚ê‚ç‚ج“إ‘f‚ة‘خ‚·‚éژ،
—أ–@‚ھگà–¾‚إ‚«‚éپB
پ@
ƒRƒŒƒ‰‚ج—ًژj‚ئŒ»ڈَ
چPڈي“I‚بگZˆْ’n‘ر‚إ‚ ‚éƒCƒ“ƒhپiƒoƒ“ƒOƒ‰ƒfƒFƒVƒ…‚جƒKƒ“ƒWƒXگىƒfƒ‹ƒ^پj‚©‚çپAژ‚ة‚ح‹ك—ׂج‹ة“Œ’n•û‚ةچL‚ھ‚è‚ًŒ©‚¹‚éپB
19گ¢‹I‚جڈ‰“ھ‚©‚ç‚U‰ٌ‚جگ¢ٹE“I”ؤ—¬چs‚ھ‚ ‚èپAƒAƒWƒAپA‰¢ڈBپA•ؤ‘ه—¤‚ة‘½گ”‚جژ€ژز‚ًڈo‚·Œ´ˆِ‚ئ‚ب‚ء‚½پB‚±‚ê‚ھچ‘چغ“I‚بƒpƒjƒbƒN‚ةٹׂêپA1851”N‚ةƒpƒٹ‚إ‰ï‹c‚ًٹJ‚‚«‚ء‚©‚¯‚ئ‚ب‚ء‚ؤپAچ‘چغ“I‚بŒِڈO‰qگ¶ڈم‚ج–â‘è‚ئ‚µ‚ؤژ‚؟ڈم‚ھ‚ء‚½پB‚±‚ê‚ç‚ج—¬چs‚حچإڈ‰‚ةپAƒLƒƒƒ‰ƒoƒ“‘àپA‘هŒ^ڈ¤‘D‚âŒR‘àˆ½‚¢‚حˆع–¯‚جˆع“®‚ة‚و‚鉈ٹفŒً’ت‚ة‚و‚ء‚ؤ‚ن‚ء‚‚è‚ئˆّ‚«‹N‚±‚³‚êپAژں‚¢‚إ“S“¹‚â‘D‚جŒً’تکHڈم‚ة—¬چs‚ھچL‚ھ‚ء‚½پBƒپƒbƒJڈ„—ç‚جŒً’ت‚ج—vڈص‚ح‹}‘¬‚ة‚»‚ج’†گS‚ئ‚ب‚ء‚½پBƒRƒŒƒ‰‹غ‚ح
Koch‚ة‚و‚ء‚ؤپA1883”NƒGƒWƒvƒg‚إ•ھ—£‚³‚ꂽپB1923
”N‚©‚ç1960”N‚ـ‚إپAƒRƒŒƒ‰‚حƒCƒ“ƒh‚ئ‹H‚ة‹ة“ŒپA‚¨‚و‚ر1947”N‚جƒGƒWƒvƒgپiƒtƒ‰ƒ“ƒX‚ة‚àڈ¬‚³‚ب—¬چs‚ًŒ©‚½پj‚ةŒہ‹ا‚³‚ê‚ؤ‚¢‚½پBڈ]—ˆ‚جƒRƒŒƒ‰‹غ‚حژه—v‚ب•aŒ´‹غ‚إ‚ ‚ء‚½‚ھپA1905”N‚ةپiƒپƒbƒJ‚جپjEl TorŒں‰uڈٹ‚إگV‚½‚بƒrƒuƒٹƒI‹غ‚ھ”Œ©‚³‚êپAEl TorƒrƒuƒٹƒI‚ئ‚µ‚ؤ’·‚¢ٹشپAٹQ‚ج‚ب‚¢‹غ‚ئچl‚¦‚ç‚ê‚ؤ‚«‚½پB1937”N‚ةƒCƒ“ƒhƒlƒVƒA‚جCelebesپiƒXƒ‰ƒEƒFƒW“‡پj‚إپA–{‹غ‚ھگ^گ³ƒRƒŒƒ‰‚جŒ´ˆِ‚ئ”»‚èپA•aŒ´گ«‚ج‰آ”\گ«‚ھ–¾‚ç‚©‚ئ‚ب‚ء‚½پBŒم‚ةڈ]—ˆ‚جƒRƒŒƒ‰‹غ‚ئ“¯—lپA•aŒ´‹غ‚ئ”F‚ك‚ç‚ê‚é‚ةژٹ‚ء‚½پB1990
”N‚جژ“_‚إپAƒRƒŒƒ‰‚حگ¢ٹE‚إ69,631—ل‚ھ•ٌچگ‚³‚ꂽپB1991”N‚ة‘و‚Vژں‚ج”ؤ—¬چs‚ھڈ‰‚ك‚ؤƒyƒ‹پ[‚جٹC‰ˆ‚¢‚ةچL‚ھ‚ء‚ؤپAڈoŒ»‚µ‚½پBŒ´ˆِ‹غ‚حگ¶•¨Œ^‚ھEl TorŒ^پAŒŒگ´Œ^‚ھˆî—tŒ^‚جƒrƒuƒٹƒI‚n1 ‚إپAƒAƒtƒٹƒJ‚ةŒ©‚ç‚ê‚é‘ه”¼‚ج‹غ‚ئˆل‚¢پA’تڈي‚جچRگ¶چـ‚ةٹ´ژَگ«‚ًژ¦‚·پB‚±‚جƒRƒŒƒ‰‹غ‚ح“ى•ؤ‚ج–w‚ا‚ئ’†•ؤ‚ة‹}‘¬‚ةچL‚ھ‚ء‚½پBƒyƒ‹پ[‚إ‚ح1991”N‚ة30–œ‚جڈا—ل‚ھ•ٌچگ‚³‚êپA‚Rگçگl‚ھژ€–S‚µ‚½پB”ؤ—¬چs‚ج‘S—e‚حژz—l‚ج”@‚‚ئ‚ب‚éپB“¯ژ‚ةƒAƒtƒٹƒJ‚إƒRƒŒƒ‰‚جچؤ—¬چs‚àژè“`‚ء‚ؤپA
پ@
ƒRƒŒƒ‰‹غ
Vibrio choleraeپ@ƒOƒ‰ƒ€‰Aگ«…‹غ
‹غ‘ج‚ھƒRƒ“ƒ}ڈَ‚ةکp‹ب
‹ة’P–ر
(+)پA‰è–E(-)ƒAƒ‹ƒJƒٹگ«‚جٹآ‹«‚إ”ˆç‚µ‚â‚·‚پAژ_‚ة‚حژم‚¢
O
چRŒ´‚ة‚و‚ء‚ؤ160ژيˆبڈم‚جŒŒگ´Œ^‚ة•ھ—قپ@پ@
چRŒ´چ\‘¢‚جˆل‚¢پ@ˆî—tŒ^پ@پ@پ@پ@پ@ڈ¬گىŒ^پ@
پ@پ@پ@•F“‡Œ^پ@
پ@گ¶•¨ٹw“Iگ«ڈَ‚جˆل‚¢پ@پ@پ@پ@پ@پ@پ@پ@پEŒأ“TŒ^
(ƒAƒWƒAŒ^)پ@پcپ@ƒGƒ‹ƒgپ[ƒ‹Œ^‹غ‚و‚è‚àŒ€ڈا
Fig.
‚P ƒRƒŒƒ‰‹غپ@
•S“ْٹP‹غ
Bordetera pertussis”ٌ‰^“®گ«پA–³‰è–Eگ«‚جچD‹Cگ«ƒOƒ‰ƒ€‰Aگ«ڈ¬’Z…‹غپB‘ج’·0.2پ`0.3پ~0.5پ`1.0ƒت‚چپB‘½Œ`گ«‚ًژ¦‚·‚±‚ئ‚ھ‚ ‚èپAن°–Œ‚ً‚à‚آپBڈم”çچ×–E‰؛گN“üگ«‚ًژ¦‚·پB“ءژê‚ب”|’n(ƒOƒٹƒZƒٹƒ“”n—éڈ’ŒŒ‰tٹ¦“V”|’nپAchocolate agar‚à‚µ‚‚حBordetپ]Gengou”|’n)‚إ‚ب‚¯‚ê‚خگ¬’·‚µ‚ب‚¢پB Fig.1‚ح“ءژê‚ب”|’n‚ة‚¨‚¢‚ؤƒRƒچƒjپ[‚ًŒ`گ¬‚µ‚½•S“ْٹP‹غ‚إ‚ ‚éپBSŒ^ƒRƒچƒjپ[‚ًŒ`گ¬(smooth colony)پB‚ـ‚½پAFig.2‚ح•S“ْٹP‹غ‚جŒ°”÷‹¾ژتگ^‚إ‚ ‚éپBگl‘جگN“üŒم‚ج‰ك’ِ‚ئ‚µ‚ؤ‚ح
پ@
‹Cٹاژx”S–Œڈم”çچ×–E‚إ’è’…پ@پcپ@“œچ½‚ًrecepter‚ئ‚µ‚ؤگü–رڈم”çچ×–EپA”x–EMƒس‚ة•t’…پAگN“üپA |
|
پ« |
|
CR3 ƒCƒ“ƒeƒOƒٹƒ“‚ًƒŒƒZƒvƒ^پ[‚ئ‚·‚éRGD’`”’”Fژ¯ |
|
پ@پ« |
|
پ@Mƒس“à‚إ’·ٹْٹشگ¶‘§(•a—“I•د‰»‚حگ¶‚¶‚ب‚¢) |
پ@
| Fig.‚Q •S“ْٹP‹غ‚جƒRƒچƒjپ[ | Fig.3 •S“ْٹP‹غ‚جŒ°”÷‹¾ژتگ^ |
|
|
 |
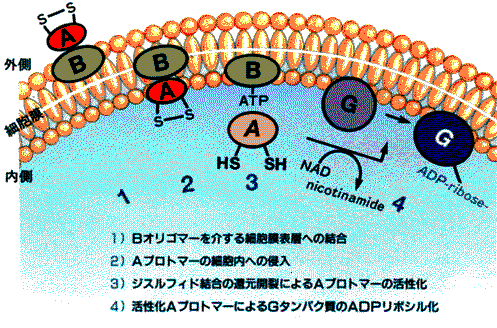
ƒRƒŒƒ‰“إ‘f
cholera toxin پiCTپjMolecular analysis of protein toxins:
ƒRƒŒƒ‰‹غƒGƒ‹ƒgپ[ƒ‹—nŒŒ“إ‚جٹˆگ«‰»‹@چ\‚ً—ل‚ةپ@ƒRƒŒƒ‰‹غ‚جژYگ¶‚·‚éƒGƒ‹ƒgپ[ƒ‹—nŒŒ“إ‚ح2’iٹK‚جƒvƒچƒZƒX‚ًژَ‚¯‚ؤٹˆگ«‰»‚·‚éپB“ٌ“x–ع‚جƒvƒچƒZƒX‚إگط’f‚³‚ê‚éƒvƒچ—جˆو‚حپA•ھژq“àƒVƒƒƒyƒچƒ“‚ئ‚µ‚ؤ‹@”\‚µ‹غ‘ج“à(ƒyƒٹƒvƒ‰ƒYƒ€)‚إ‚ج“إ‘f‚ج—§‘جچ\‘¢Œ`گ¬‚ة“‚¢‚½ŒمپA‹غ‘جٹO(’°ٹا)‚إ—lپX‚بƒvƒچƒeƒAپ[ƒ[‚ة‚و‚èژو‚èڈœ‚©‚êپA“إ‘f‚ھٹˆگ«‰»‚³‚ê‚éپBپ@
پ@
پ@
2.
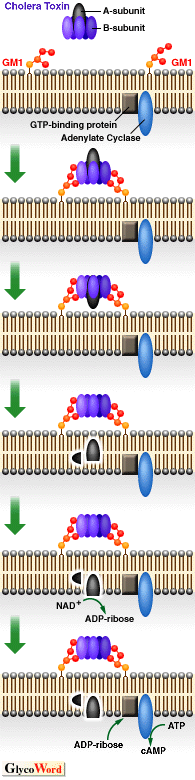
چ\‘¢‚ئ‹@”\’°گ›ڈم”çچ×–E‚ة’è’…‚µ‚½ƒRƒŒƒ‰‹غ‚ح‘گB‚ة”؛‚ء‚ؤƒRƒŒƒ‰“إ‘f‚ًژYگ¶‚·‚éپD‹غ‘جٹO‚ة”rڈo‚³‚ꂽƒRƒŒƒ‰“إ‘f‚ح‚Q‚آ‚جƒ^ƒ“ƒpƒN‚©‚çچ\گ¬‚³‚ê‚ؤ‚¢‚éپD‚·‚ب‚ي‚؟پA
28kDa‚ج“إ‘fپiچy‘fپjٹˆگ«•”•ھ‚ئپA8kDa‚جƒTƒuƒ†ƒjƒbƒg‚ھ‚TŒآ‚إچ\گ¬‚³‚ê‚é‚aƒIƒٹƒSƒ}پ[‚إ‚ ‚éپDAپABƒ^ƒ“ƒpƒN‚حچ׋غ‚جگُگF‘جڈم‚ة‚ ‚éctxA,ctxBˆâ“`ژq‚جژY•¨‚إپA—¼ژز‚حƒIƒyƒچƒ“‚ًŒ`گ¬‚µ‚ؤ‚¢‚éپD‚`ƒ^ƒ“ƒpƒN‚ح–|–َŒمپA‹غژ©‚ç•ھ”ه‚·‚éƒ^ƒ“ƒpƒN•ھ‰ًچy‘f‚â’°ٹا“à‚جƒgƒٹƒvƒVƒ“‚ة‚و‚ء‚ؤƒjƒbƒN‚ھ“ü‚è‚r‚rŒ‹چ‡‚إŒ‹‚خ‚ꂽ‚`‚PپA‚`‚Q‚ج“ٌ‚آ‚جƒtƒ‰ƒOƒپƒ“ƒg‚ئ‚ب‚éپD‚aƒIƒٹƒSƒ}پ[‚حچ×–E•\–ت‚جƒŒƒZƒvƒ^پ[پAGM1ƒKƒ“ƒOƒٹƒIƒVƒh‚ئ‹‚Œ‹چ‡‚µ¤ƒRƒŒƒ‰“إ‘f‚ھچ×–E•\–ت‚ة‹z’…‚·‚é–ًٹ„‚ً’S‚ء‚ؤ‚¢‚éپBƒŒƒZƒvƒ^پ[‚ةŒ‹چ‡ŒمپAA1-A2ٹش‚جSSŒ‹چ‡‚حƒOƒ‹ƒ^ƒ`ƒIƒ““™‚جٹزŒ³•¨ژ؟‚ة‚و‚èگط’f‚³‚ê¤A1ƒTƒuƒ†ƒjƒbƒg‚حچ×–E“à‚ة‰ں‚µچ‚ـ‚ê‚éپBFig.5
ƒRƒŒƒ‰“إ‘fپiCTپj‚ج–حŒ^
Fig.6
ƒRƒŒƒ‰ƒgƒLƒVƒ“‚جtransmembrane‚ج—lژq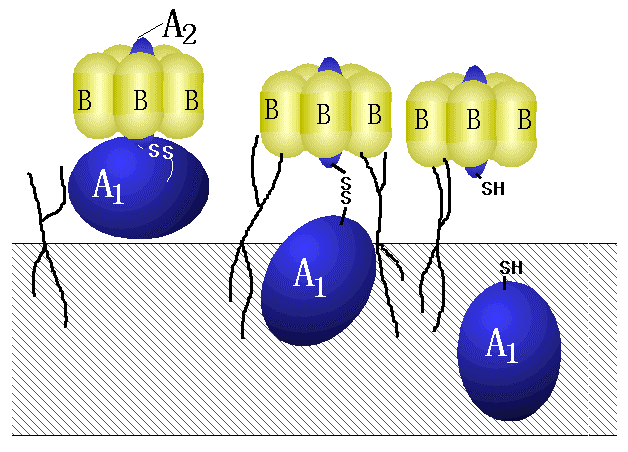
پ@
3.
چ׋غ‚¨‚و‚رچ׋غ“إ‘fƒŒƒZƒvƒ^پ[‚ئ‚µ‚ؤ‚ج“œژ‰ژ؟پ@•aŒ´گ«چ׋غ‚âچ׋غ“إ‘f‚ھچ×–E‚ةٹ´گُ‚µ‚½‚è“إچى—p‚ً”ٹِ‚·‚邽‚ك‚ة‚حپAگو‚¸پAچ×–E–Œ•\–ت‚ةŒ‹چ‡‚µ‚ب‚¯‚ê‚خ‚ب‚ç‚ب‚¢پB•aŒ´گ«چ׋غ‚âچ׋غ“إ‘f‚ھچ×–E‚ةŒ‹چ‡‚·‚郌ƒZƒvƒ^پ[‚حچ×–E–Œڈم‚ة‘¶چف‚·‚éƒXƒtƒBƒ“ƒS“œژ‰ژ؟‚إ‚ ‚éپB
پ@چ×–E–Œڈم‚جژ_گ«ƒXƒtƒBƒ“ƒS“œژ‰ژ؟‚إ‚ ‚éƒKƒ“ƒOƒٹƒIƒVƒh‚ًƒŒƒZƒvƒ^پ[‚ئ‚µ‚ؤچ×–E‚ةŒ‹چ‡‚µٹ´گُ‚·‚é“إ‘f‚حگ”‘½‚¢پBچإ‚à—ا‚’m‚ç‚ê‚ؤ‚¢‚é‚ج‚حƒRƒŒƒ‰“إ‘f‚إپA‚»‚جƒŒƒZƒvƒ^پ[‚ح
GM1‚إ‚ ‚éپBƒRƒŒƒ‰“إ‘f‚ح“إ‘f–{—ˆ‚جگ¶•¨ٹˆگ«‚ً—L‚·‚éAƒTƒuƒ†ƒjƒbƒg‚ً‚TŒآ‚جBƒTƒuƒ†ƒjƒbƒg‚ھژو‚èˆح‚ق‚و‚¤‚بچ\‘¢‚ً‚µ‚ؤ‚¨‚èپAچ×–E–Œڈم‚جGM1‚ئŒ‹چ‡‚·‚é‚ج‚حBƒTƒuƒ†ƒjƒbƒg‚إ‚ ‚éپBBƒTƒuƒ†ƒjƒbƒg‚ھGM1‚ةŒ‹چ‡‚·‚é‚ئ‚ئ‚à‚ةƒRƒŒƒ‰“إ‘f‚ج—§‘جچ\‘¢‚ھ•د‰»‚µ‚ؤپAAƒTƒuƒ†ƒjƒbƒg‚ھچ×–E‚ج–Œ‚©‚çگN“ü‚·‚éپBBƒTƒuƒ†ƒjƒbƒg‚ح‚P‚O‚RŒآ‚جƒAƒ~ƒmژ_‚©‚ç‚ب‚èپAGM1‚ئ‚جŒ‹چ‡‚ة‚حN––’[‚©‚ç‚W‚W”ش–ع‚جƒgƒٹƒvƒgƒtƒ@ƒ“‚â‚R‚T”ش–ع‚جƒAƒ‹ƒMƒjƒ“‚ھٹض—^‚µ‚ؤ‚¢‚邱‚ئ‚ھ’m‚ç‚ê‚ؤ‚¢‚éپB“إ‘fŒ´گ«‘ه’°‹غ‚ھژYگ¶‚·‚éˆص”Mگ«“إ‘f‚à—قژ—‚ج‹@چ\‚إGM1‚ًƒŒƒZƒvƒ^پ[‚ئ‚µ‚ؤچ×–E‚ةŒ‹چ‡‚µگN“ü‚·‚éپBƒKƒ“ƒOƒٹƒIƒVƒh‚ًƒŒƒZƒvƒ^پ[‚ئ‚·‚éچ׋غ“إ‘f‚ة‚ح‘¼‚ة”jڈ•—“إ‘fپiGD1bپjپAƒ{ƒcƒٹƒkƒX“إ‘fپiGT1b‚ئGQ1bپjپAƒEƒGƒ‹ƒVƒ…‹غپiClostridium perfringensپj‚جƒfƒ‹ƒ^“إ‘fپiGM2پj‚ب‚ا‚ھ‚ ‚éپBگش—ں‹غپiShigella dysenteriaeپj‚ھژYگ¶‚·‚éژu‰ê“إ‘f‚â’°ٹاڈoŒŒگ«‘ه’°‹غ‚ھژYگ¶‚·‚éƒxƒچ“إ‘f‚حƒAƒ‹ƒtƒ@پ[-1,4 ƒKƒ‰ƒrƒIپ[ƒX‚ًٹـ‚ق’†گ«“œژ‰ژ؟‚جGa2CerپiƒKƒ‰ƒrƒIƒVƒhپj‚âGb3CerپiƒZƒ‰ƒ~ƒhƒgƒٹƒwƒLƒ\ƒVƒhپj‚ًƒŒƒZƒvƒ^پ[‚ئ‚·‚éپBپ@ˆê•ûپA‘½‚‚ج•aŒ´گ«چ׋غ‚àƒXƒtƒBƒ“ƒS“œژ‰ژ؟‚ًچ×–E–Œڈم‚جƒŒƒZƒvƒ^پ[‚ئ‚·‚éپBƒqƒg‚ج”AکHٹ´گُڈا‚ًˆّ‚«‹N‚±‚·‘ه’°‹غ‚حƒAƒ‹ƒtƒ@پ[
-1,4 ƒKƒ‰ƒrƒIپ[ƒX‚ً“œچ½‚ج––’[‚ةژ‚آ“œژ‰ژ؟پiGb3Cer‚ب‚اپj‚ةŒ‹چ‡‚·‚éپBچ׋غ‚ح“œچ½‚ج––’[•”•ھ‚ج‚ف‚ب‚炸پA“œچ½‚ج“à•”‚ج”z—ٌ‚ً‚à”Fژ¯‚µ‚ؤŒ‹چ‡‚·‚邱‚ئ‚ھ‚إ‚«‚é‚ئŒ¾‚¤“ء’¥‚ھ‚ ‚éپBڈم‹L‚ج‘ه’°‹غ‚حƒAƒ‹ƒtƒ@پ[-1,4 ƒKƒ‰ƒrƒIپ[ƒX‚ً“œچ½‚ج“à•”‚ةژ‚آGb4CerپiƒOƒچƒ{ƒVƒhپj‚âƒtƒHƒ‹ƒXƒ}ƒ“چRŒ´‚ب‚ا‚ج“œژ‰ژ؟‚ة‚àŒ‹چ‡‚µپA‚±‚ج‚و‚¤‚ب•ھژq‚ًƒCƒ\ƒŒƒZƒvƒ^پ[‚ئŒؤ‚ٌ‚إ‚¢‚éپB‘ه’°‹غ‚ة‚¨‚¢‚ؤ“œژ‰ژ؟“œچ½‚ئ‚جŒ‹چ‡‚ح‹غ‘ج•\‘w‚ة‘@ˆغڈَ‚ة•ھ•z‚·‚éگü–ر‚ً‰î‚µ‚ؤچs‚ي‚ê‚éپBگü–ر‚جگو’[‚ة‚حƒAƒhƒwƒVƒ“‚ئŒؤ‚خ‚ê‚郌ƒNƒ`ƒ“‚ھ‘¶چف‚µپA‹غژي‚ة‚و‚ء‚ؤ‚hŒ^-ƒAƒhƒwƒVƒ“پiƒ}ƒ“ƒmپ[ƒX“ءˆظ“IپjپA‚o-ƒAƒhƒwƒVƒ“پiƒKƒ‰ƒrƒIپ[ƒX“ءˆظ“IپjپA‚r-ƒAƒhƒwƒVƒ“پiƒVƒAƒٹƒ‹ƒKƒ‰ƒNƒgپ[ƒX“ءˆظ“Iپj‚ب‚اپA“ءˆظگ«‚ھˆظ‚ب‚郌ƒNƒ`ƒ“‚ًژ‚آپB‚o-ƒAƒhƒwƒVƒ“‚ح“¯‚¶ƒAƒ‹ƒtƒ@پ[-1,4 ƒKƒ‰ƒrƒIپ[ƒX‚ً”Fژ¯‚·‚éژu‰ê“إ‘f‚ئƒAƒ~ƒmژ_”z—ٌ‚ھ—قژ—‚µ‚ؤ‚¢‚邱‚ئ‚ھ•ٌچگ‚³‚ê‚ؤ‚¢‚éپB”畆‰ٹ‚ًˆّ‚«‹N‚±‚·ƒvƒچƒsƒIƒ“ژ_‹غپiPropionibacteriumپj‚ح“œژ‰ژ؟“œچ½‚جƒ‰ƒNƒgپ[ƒX•”ˆت‚ً”Fژ¯‚µ‚ؤŒ‹چ‡‚·‚éپB‚»‚êŒج‚ةƒ‰ƒNƒgƒVƒ‹ƒZƒ‰ƒ~ƒh‚ة‹‚Œ‹چ‡‚µپAƒCƒ\ƒŒƒZƒvƒ^پ[‚جƒAƒVƒAƒچGM1پiGA1پj‚âƒAƒVƒAƒچGM2پiGA2پj‚ة‚àŒ‹چ‡‚·‚éپBƒ‰ƒNƒgپ[ƒX•”ˆت‚ح‚ظ‚ئ‚ٌ‚ا‚جƒXƒtƒBƒ“ƒS“œژ‰ژ؟‚ج“œچ½‚ة‹¤’ت‚ة‘¶چف‚·‚é‚ج‚إپAƒvƒچƒsƒIƒ“ژ_‹غ‚ح‚»‚ê‚ç‘S‚ؤ‚ج“œژ‰ژ؟‚ةŒ‹چ‡‚µ“¾‚é‚ح‚¸‚إ‚ ‚é‚ھپA•K‚¸‚µ‚à‚»‚¤‚إ‚ح‚ب‚¢پBژ‰ژ؟•”•ھپiƒZƒ‰ƒ~ƒhپj‚جˆê•”‚ةگ…ژ_ٹî‚ھٹO‚ê‚ؤ‚¢‚é‚و‚¤‚ب“œژ‰ژ؟‚ة‚ح‹غ‚حŒ‹چ‡‚µ‚ب‚¢پB‘¦‚؟پAژ‰ژ؟•”•ھ‚àŒ‹چ‡‚ةٹض—^‚µ‚ؤ‚¢‚éپB—ز‹غپiNeisseria gonorrhoeaeپj‚àƒ‰ƒNƒgپ[ƒX•”ˆت‚ًژ‚آ“œژ‰ژ؟‚ةŒ‹چ‡‚·‚éپBپ@ƒAƒ‹ƒtƒ@پ[
-1,4 ƒKƒ‰ƒrƒIپ[ƒX‚جچ\‘¢‚ً“œچ½‚ةژ‚آ“œژ‰ژ؟پiƒOƒچƒ{ƒVƒh‚ب‚اپj‚حپAƒAƒ‹ƒtƒ@پ[-1,4 ƒKƒ‰ƒrƒIپ[ƒX‚ج•”•ھ‚ھ‚؟‚ه‚¤‚اکp‹ب‚µ‚½Œ`‚ة‚ب‚ء‚ؤ‚¨‚èپA“ت–تڈَ‚ج‘¤‚ھ‹غ‘ج‚ئ‚جŒ‹چ‡‚جƒGƒsƒgپ[ƒv‚ة‚ب‚ء‚ؤ‚¢‚é‚ئچl‚¦‚ç‚ê‚ؤ‚¢‚éپBچإ‹كپA’°“à‚إگ®’°چى—p‚ًچs‚¤—L—p‚ب“ûژ_‹غ‚àƒXƒtƒBƒ“ƒS“œژ‰ژ؟‚ةŒ‹چ‡‚·‚邱‚ئ‚ھŒ©ڈo‚³‚ꂽپBژه‚ئ‚µ‚ؤ’†گ«“œژ‰ژ؟‚ةŒ‹چ‡‚µپAƒKƒ“ƒOƒٹƒIƒVƒh‚ة‚ح‘S‚Œ‹چ‡‚µ‚ب‚¢پBپ@
پ@
4.
چ×–E“à‚إ‚جƒRƒŒƒ‰ƒgƒLƒVƒ“‚ج“إگ«”½‰چ×–E“à‚ة‰ں‚µچ‚ـ‚ꂽ
A1ƒtƒ‰ƒOƒپƒ“ƒg‚حNAD‚ً”Fژ¯‚µپA‚»‚جADPƒٹƒ{پ[ƒXٹî‚ًگط’f‚µپAƒAƒfƒjپ[ƒ‹ژ_ƒVƒNƒ‰پ[ƒ[‚جٹˆگ«‚ًگ§Œن‚µ‚ؤ‚¢‚éƒ^ƒ“ƒpƒNGsƒ؟گ¬•ھ‚ةADPƒٹƒ{ƒVƒ‹ٹî‚ً“]ˆع‚·‚éپB‚±‚جADPƒٹƒ{ƒVƒ‹‰»‚ة‚و‚èپAGsƒ؟‚حGTPaseٹˆگ«‚ًژ¸‚ب‚¢پAƒAƒfƒjƒ‹ژ_ƒVƒNƒ‰پ[ƒ[‚ً•s‰آ‹t“I‚ةٹˆگ«Œ^‚ة‚ب‚éپDگ§Œنƒ^ƒ“ƒpƒN‚حGTPŒ^‚ئGDPŒ^‚ً‚ئ‚èپAGsƒ؟‚ج•sٹˆ‰»‚ة‚و‚èGTPŒ^‚ئ‚ب‚褃Aƒfƒjƒ‹ژ_ƒVƒNƒ‰پ[ƒ[‚ھٹˆگ«Œ^‚ة—¯‚ـ‚é(Fig.8)پD‚±‚ج‚و‚¤‚بƒAƒfƒjƒ‹ژ_ƒVƒNƒ‰پ[ƒ[‚جژ‘±“I‚بٹˆگ«‰»‚ج‚½‚ك‚ةcAMP‚جچ×–E“à”Z“x‚ھچ‚‚ـ‚éپDcAMPڈمڈ¸‚©‚ç‰؛—ں‚ـ‚إ‚جƒپƒJƒjƒYƒ€‚حڈ\•ھ‚ة–¾‚ç‚©‚ة‚ب‚ء‚ؤ‚¢‚ب‚¢‚ھپCcAMP‚جڈمڈ¸‚ة‚و‚ء‚ؤƒ^ƒ“ƒpƒNƒJƒCƒlپ[ƒX‚جٹˆگ«‰»‚ض‚ئ“±‚©‚êپC‚¢‚‚آ‚©‚جƒ^ƒ“ƒpƒNƒٹƒ“ژ_‰»‚ج‰ك’ِ‚ًŒo‚½ŒمپCƒCƒIƒ“—A‘—‚ةٹض‚·‚éƒ^ƒ“ƒpƒN‚جƒٹƒ“ژ_‰»‚ة‹Nˆِ‚µ‚ؤپC’°گ›ڈم”çچ×–E‚ة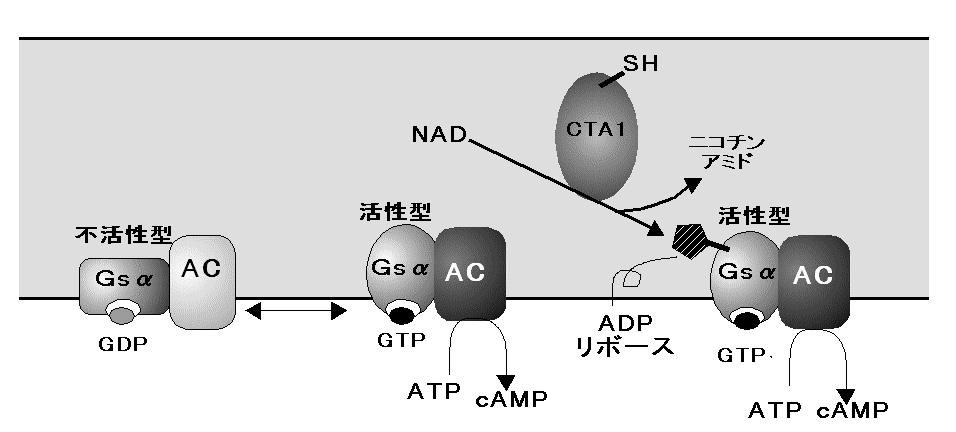
Fig.8
چ×–E“à‚إ‚جƒRƒŒƒ‰ƒgƒLƒVƒ“‚ج”½‰Fig.9
گ³ڈيGs protein ‚ئ ƒٹƒ{ƒVƒ‹‰»‚³‚ꂽ‚à‚ج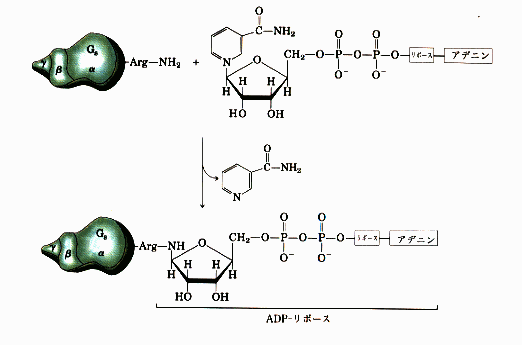
“TŒ^“I‚بڈا—ل
گِ•ڑٹْ‚ح’Z‚پA‚س‚آ‚¤‚Q
-‚R“ْپA—¬چsٹْ‚â‘ه—تگغژو‚µ‚½ڈêچ‡‚حگ”ژٹشپAگZˆْٹْ‚إ‚ح‚R-‚V“ْ‚إ‚ ‚éپB”ڈا‚ح‹}Œƒ‚¾‚ھپAŒ’چN‚بژز‚ح‚·‚®–â‘è‚ھگ¶‚¶‚ب‚¢پBگSâ|•”‚ج’£‚èپA’°–آپA‹ê–مٹ´‚ھ‚ ‚èپAژں‚¢‚إ’تڈي—ت‚و‚葽‚ك‚ج”r•ض‚©‚çپAگ”‰ٌ‘±‚¯‚ؤٹشٹu‚ج’Z‚¢‰؛—ں‚ة‚ب‚éپB’_ڈ`‚جچ¬‚¶‚ء‚½ڑq“f‚ً‚·‚éپB
چإڈ‰‚ج‚P
-‚Qژٹش‚ظ‚ا‚ح—صڈ°ڈم‚ج—e‘ش‚ح‚µ‚ء‚©‚肵‚ؤ‚¢‚éپB•ض’ت‚ة‚حگه’ة‚ً”؛‚ي‚¸پA• •”‚ج’£‚è‚حٹةکa‚µ‚ب‚¢‚ھپAٹ³ژز‚ح”و•¾‚·‚éپB•ض‚ح–³گF‚إ“ُ‚¢‚ح–w‚ا‚ب‚پA‚ح‚ء‚«‚è‚ئگ…—l‚ئ‚ب‚ء‚ؤپA—LŒ`•ض‚إ‚ح‚ب‚‚ب‚éپB‚±‚ê‚حڈ]—ˆ‚©‚ç•ؤ‚ج‚ئ‚¬ڈ`—lپiڈ¬—±‚ج‰ٍ‚ًٹـ‚قپj‚ئڈج‚³‚ê‚éپBڈ‰ٹْ‚ة‰؛—ں•ض‚ح•¬ڈo‚·‚é‚ھپAژں‘و‚ة”و•¾‚µ‚½ٹ³ژز‚جٹ‡–ٌ‹ط‚©‚çکR‚êڈo‚é‚و‚¤‚ة‚ب‚èپAˆى‚ê‚é‚ظ‚ا‚ج—ت‚إˆك—ق‚âˆع‘—’†‚ةژg‚¤ن²نو‚ً‰ک‚·پB•ضˆبٹO‚ة‚àڑq“f‚ھ“ء’¥“I‚إ‚ ‚éپBچإڈ‰‚ح—}‚¦‚ç‚ꂸ‚ة“ثڈo‚µپA‚»‚جŒمٹ³ژز‚جŒû‚©‚çژ©‘R‚ة—¬ڈo‚·‚éپB“f•¨‚ح‚â‚ح‚èگ…—l‚إپA•ؤ—±‘ه‚جڈ¬—±‚ًٹـ—L‚·‚éپBڈء‰»ٹا‚©‚ç‚ج‘ه—ت‚ج—¬ڈo‚حپAگ”ژٹش‚إگ”ƒٹƒbƒgƒ‹‚ة‹y‚رپA‘S‘ج“I‚بگٹژم‚ًˆّ‚«‹N‚±‚·پBٹ³ژز‚حگ…‚ًˆù‚ٌ‚إ‚àŒûٹ‰‚ً‘i‚¦پAژlژˆ‚©‚狹• •”‚ةچL‚ھ‚éپAŒƒ‚µ‚¢’ة‚ف‚ً”؛‚¤‹ط“÷‚جلz¹‚ً”F‚ك‚éپB‚±‚جژ“_‚إ‚جٹ³ژز‚ج—e‘ش‚ج“ء’·‚حپAˆسژ¯‚ح–¾—ؤ‚¾‚ھپAگ؛‚حڑm‚ê‚ؤ•·‚«ژو‚ꂸپA‚â‚آ‚ꂽٹç–e‚ئ‚ا‚ٌ‚و‚肵‚½–ع‚ئ‚»‚جژü‚è‚ةŒG‚ھگ¶‚¶پAٹلâ|‚ح—ژ‚؟ŒE‚ٌ‚إپAŒûگO‚جƒ`ƒAƒmپ[ƒ[‚ھ‚ ‚èپA‘ج•\‚ح‚ث‚خ‚ث‚خ‚µ‚½ٹ¾‚إ•¢‚ي‚ê‚éپB“ï–¯ƒLƒƒƒ“ƒv‚إ24ژٹش‚ظ‚اŒo‰ك‚µ‚½ژ“_‹Q‰ىڈَ‘ش‚جƒRƒŒƒ‰ٹ³ژز‚ج—e‘ش‚حپA‚±‚ج‚و‚¤‚ةŒ©‚¦‚éپB–¬‚ح‘¬‚پA‚µ‚خ‚µ‚خگG’mڈo—ˆ‚ب‚¢پB–¬ˆ³‚حژم‚پAگS‰¹‚ح”÷‚©‚ة’®ژو‚³‚êپAŒؤ‹zچ¢“ï‚ئ–³”A‚ھ”F‚ك‚ç‚ê‚éپB36پژ‚ظ‚ا‚ج’ل‘ج‰·‚إˆ«ٹ¦‚ھ‚ ‚éپB‚±‚ج‚و‚¤‚بŒأ“T“I‚بڈا—ل‚إ‚حپAژ،—أ‚ًچs‚ب‚ي‚ب‚¢‚ئپA‘ج‰t‚جٹ®‘S‚بکRڈo‚ة‚و‚é‹•’E‚ئگt•s‘S‚إپAٹ³ژز‚ح48-72ژٹش‚إژ€–S‚·‚éپB—صڈ°ڈمŒ©‚©‚¯‚éڈا—ل
‘½چت‚ب—صڈ°ڈاŒَ‚ج‚½‚كپAŒثکf‚¤‚±‚ئ‚ھ‚ ‚éپB‰؛—ں‚ح’·‚¢Œo‰ك’†‚ةŒŒگ«‚ئ‚ب‚邱‚ئ‚ھ‚ ‚é‚ھپA‚·‚®‚ة‚ح‹N‚±‚炸پAڑq“f‚ح‘ه—ت‚إ‚ب‚¢پB‘ج‰·‚à•½”M‚©
37.5-38پژ‚ةڈمڈ¸‚·‚邱‚ئ‚ھ‚ ‚éپBپsٹ£گ«پtƒRƒŒƒ‰‚إ‚حپA’°ٹا‚©‚ç‚ج‘ج‰t—¬ڈo‚ھ•\–ت‰»‚µ‚ب‚©‚ء‚½‚èپA‘O‹ى“I‚ب‰؛—ںڈاڈَ‚ھ‚ ‚ء‚½‚¾‚¯‚إپA’Eگ…‚ھŒ©‚ç‚ê‚é‘O‚ة‹•’E‚ھ‹N‚±‚èپA“ث‘Rژ€‚ًˆّ‚«‹N‚±‚·پB‚±‚ج‚و‚¤‚بڈا—ل‚ح”نٹr“I‘½‚¢‚ھپAٹ³ژز‚حگf—أڈٹ‚ة“’…‚·‚é‘O‚ةژ€–S‚·‚éپB
’تڈي‚جڈdڈاŒ^‚حژ©‘Rٹ°‰ً‚·‚邱‚ئ‚ھ‚ ‚éپB‚ـ‚¸ڑq“f‚ھژ،‚ـ‚èپAٹ³ژز‚حˆùگH‚ھ‰آ”\‚ئ‚ب‚ء‚ؤپAژ©‚ç•â‰t‚·‚éپB‰؛—ں‚حگ”“ْٹشژ‘±‚·‚é‚ھپA—ک”A‚ھ‰ٌ•œ‚µ‚ؤ‘Sگgڈَ‘ش‚ح‰ü‘P‚·‚éپB
38پژ‚ة’B‚·‚é”M”‚ھ‚ ‚èپAڈ‹‚‚ؤ”ٹ¾‚·‚ê‚خپA—\Œم‚ح—اچD‚إ‚ ‚éپB‹»•±‚â’mٹo‰ك•q‚ً”؛‚¤“ٌژںگ«‚ج‹•’E‚âگ_Œo-”]ڈلٹQ‚ھŒ©‚ç‚ê‚邱‚ئ‚ھ‚ ‚éپB—اگ«—ل‚ح•p”ة‚ة‚ ‚èپA””M‚ج‚ب‚¢‹}گ«ˆف’°ڈلٹQپA‚ـ‚½‚ح•پ’ت‚ج‰؛—ں‚ً”F‚كپAگf’f‚ح“‚¢پB
ƒRƒŒƒ‰‚ة“ءˆظ“I‚ب‘جژ؟‚ح‚ب‚¢پBڈ¬ژ™‚ح‘ه’ïپAگZˆْڈَ‘ش‚©—¬چs‚ج––ٹْ‚ةœëٹ³‚µپAگ¶–½‚جٹ댯‚ح‘هگl‚و‚èچ‚‚¢پBچ‚—îژز‚حگS‹@”\’ل‰؛‚©“ٌژںگ«گt•s‘S‚إژ€–S‚·‚邱‚ئ‚ھ‘½‚¢پB”D•w‚ح‚س‚آ‚¤—¬ژY‚·‚éپB
گf’f
پsڈd“ؤ‚ب‰؛—ں‚ة‘±‚¢‚ؤڑq“f‚µپAگ”ژٹشŒم‚ةژ€‚ت‘هگl‚حپA–w‚ا‘S‚ؤƒRƒŒƒ‰‚إ‚ ‚éپt
(Lapeyssonnie)‚ئ‰]‚ي‚ê‚é‚‚ç‚¢پA‘¼‚ة‹^‚ي‚ê‚éژ¾ٹ³‚حڈ‚ب‚¢‚ھپAڈ‰ٹْ‚جڈا—ل‚حڈٹŒ©‚ھ‘S‚”F‚ك‚ç‚ꂸپAگf’fڈم–â‘è‚ئ‚ب‚邱‚ئ‚ھ‚ ‚éپBچ׋غٹw“Iگf’f‚إ‚حڈي‚ةپA‰qگ¶ڈَ‘ش‚ًچl—¶‚ة“ü‚ꂽژè’i‚ھژو‚ç‚ê‚ث‚خ‚ب‚ç‚ب‚¢پB—¬چs’†‚ة‚±‚ê‚ًچs‚ب‚¤‚ج‚ح–³‘ت‚إ‚ ‚éپB—¬چs‚ج––ٹْ‚إ‚حپAƒRƒŒƒ‰‚جگf’f‚حپA‹t‚ة‹ة‚ك‚ؤٹب’P‚ةچs‚ب‚ي‚ê‚éپB‚و‚Œ©Œë‚éژ¾ٹ³‚ةپAگش—ںپAƒTƒ‹ƒ‚ƒlƒ‰ڈاپAگH’†“إپAƒ}ƒ‰ƒٹƒA‚ئپAڈء‰»ٹاڈلٹQ‚ً”؛‚¤چ׋غگ«‚ـ‚½‚حƒEƒCƒ‹ƒXگ«ژ¾ٹ³‚ھ‰½‚إ‚à‹“‚°‚ç‚ê‚éپB‚±‚ê‚ç‚جژ¾ٹ³‚ج‹Gگك“I‚بچؤ”‚حپAٹm‚©‚ةƒRƒŒƒ‰—¬چs‚ج––ٹْ‚ة‚و‚Œ©‚ç‚ê‚éپBپ@
ژ،—أ
ƒRƒŒƒ‰‚ة‘خ‚·‚é—‘z“I‚بژ،—أ‚حپAگف”ُ‚ھگ®‚ء‚½•a‰@‚إپAٹ³ژزگ”‚ھڈ‚ب‚¢ڈêچ‡‚ة‚حپA—eˆص‚ةژہژ{‰آ”\‚ئچl‚¦‚ç‚ê‚éپB‚µ‚©‚µگ”ڈ\گl‚©‚»‚êˆبڈم‚جٹ³ژز‚ھپAˆم—أژ{گف‚جگ®‚ء‚ؤ‚¢‚ب‚¢پA‰¼گف‚جگf—أڈٹ‚ةˆê“x‚ة‰ں‚µٹ|‚¯‚½ژ‚ة‚حپAڈu‚ٹش‚ة”j’]‚µپAڈو‚è‰z‚¦‚ھ‚½‚¢چ¢“ï‚ة’¼–ت‚µ‚ؤ‚µ‚ـ‚¤پBٹwگà‚إ‚ح‚Pپ“‚ئ‚³‚ê‚éژ€–S—¦‚àپAچإ‚à”كژS‚ب’nˆو‚إ‚ح
50پ“‚ة‚ج‚ع‚èپA10پ“‚ً‰؛‰ٌ‚é‚ـ‚إ‰ü‘P‚·‚邱‚ئ‚ح‚ب‚¢‚ئڈط–¾‚³‚êپAٹu‚½‚è‚ھ‚ ‚éپB—\Œم‚ح•خ‚ةژ،—أ‚جگv‘¬گ«‚ة‚©‚©‚ء‚ؤ‚¢‚éپBژ¾•a‚ة‚و‚éچ¬—گ‚حپAژ،—أژ{گف‚جگف”ُ‚ة‚و‚é’¼گع“IڈًŒڈ‚ئپAژ،—أ‚ة“–‚½‚éژز‚جژ؟‚ئ—ت‚ة”½”ن—ل‚µ‚ؤ‹N‚±‚éپB‘ه—ت‚©‚آ‹}‘¬‚ب•â‰t‚ئ“d‰ًژ؟•â‹‹‚ًگ”ژٹش‚إچs‚ب‚¤‚±‚ئ‚ھپA–{ڈا‚ج‘hگ¶‚ئ‚ب‚éپB“ûژ_ƒJƒ‹ƒVƒEƒ€“ü‚è
Ringer-Hartmann‰t‚ًپAڈd’Yژ_‰–‚ئ“™’£گH‰–گ…‚إچ¬چ‡‚µپA1,000ml ‚ً15•ھ‚إگأ’چ‚µپA‰آ”\‚إ‚ ‚ê‚خ‘جڈd‚ج10پ“‚ة“–‚½‚éپA•½‹د‚T-‚Uƒٹƒbƒgƒ‹‚ً‚R-‚Tژٹش‚إ“H‰؛‚·‚éپBگأ’چ‚إ‹گSچـ‚ـ‚½‚حƒXƒeƒچƒCƒh‚ًچ²چـ‚ئ‚µ‚ؤ•¹—p‚·‚邱‚ئ‚ھ‚ ‚éپB‚Pژٹشˆب“à‚ة–¬‚حگG’m‰آ”\‚ئ‚ب‚èپA‹•’EپAڑq“fپAلz¹‚ح‚T-‚Uژٹش‚إڈءژ¸‚·‚é‚ھپA‰؛—ں‚حژ‘±‚·‚éپB‘Oڈq‚ج—A‰t‚ًپA‰؛—ں‚ج—e‘ش‚ة‰‚¶‚ؤ36-48ژٹشپA‘O‚و‚è‚ن‚ء‚‚è’ا‰ء“ٹ—^‚·‚éپB‘چŒv‚إ•½‹د‚W-12ƒٹƒbƒgƒ‹•K—v‚ئ‚ب‚é‚ھپA‰؛—ں‚ھژ‘±‚·‚éڈêچ‡پA‚Sژٹش‚إ20-25ƒٹƒbƒgƒ‹•â‰t‚·‚é•K—v‚ھ‚ ‚éپB‚à‚µ‚à—A‰t‚âٹي‹ï‚ھ‚ب‚¢ژ‚حپAڑq“f‚ھژ،‚ـ‚ء‚ؤ‚¢‚ê‚خپAŒoŒû‚إ‰–پA“œپAڈd’Yژ_‰–‚ً“ٹ—^‚·‚éپBڈ¬ژ™‚ة•â‰t‚ًچs‚ب‚¤چغ‚ة‚حپA—A‰t“à—e‚ة—¯ˆس‚µپAƒJƒٹƒEƒ€‚حڈ‚ب‚ك‚ة‚·‚éپBچ‚—îژز‚âگS‘ں•a‚ً‚à‚آژز‚إ‚حپA—A‰t‚ج‘¬“x‚ً‚â‚â’x‚ك‚ة‚·‚éپBپ@
—\–h
ˆê”ت“I‚ب‰qگ¶ڈم‚ج•û–@پFƒRƒŒƒ‰‘خچô‚ة•Kگ{‚جژè’i‚إ‚ ‚éپB‰qگ¶ڈَ‹µ‚ھ—اچD‚بچ‘‚إ‚حپAƒRƒŒƒ‰‚جٹ댯گ«‚حŒہ‚ç‚ê‚é‚ھپA‚»‚ê‚ھ•sڈ\•ھ‚بچ‘‚إ‚حپA‚»‚جٹ댯گ«‚ح‹ة‚ك‚ؤچ‚‚¢پBŒyڈا—ل‚â•sٹmژہ‚بڈا—لپAˆ½‚¢‚ح“ث”“I‚ب—¬چs‚جŒم‚إ‚حپA‚±‚ج•û–@‚إ‚ح—\–h‚ح•s‰آ”\‚إ‚ ‚éپBگ…‚ـ‚½‚حگH•i‚ً‰î‚µ‚ؤ‚جگlٹش“¯ژm‚ج“`گُ‚ھ—Dˆت‚بڈêچ‡پAŒآگl‚ج—\–h‚ھٹî–{‚ئ‚ب‚èپAژں‚¢‚إٹآ‹«‚ھ–â‘è‚ئ‚ب‚éپBژه—v‚بژè’i‚ئ‚µ‚ؤ‰qگ¶‰»‚ًگi‚ك‚ؤ‚¨‚¯‚خپA—¬چs‚ةŒ©•‘‚ي‚ꂽچغ‚ةپA‚»‚±‚¾‚¯‚ھ”يٹQ‚ً–ئ‚ê‚éپB“`گُ‚جٹ댯‚ھ‚ ‚éŒآگl‚âڈW’c‚ً•غŒى‚·‚邱‚ئ‚àٹج—v‚جˆê‚آ‚إ‚ ‚éپBƒAƒtƒٹƒJ‚إ‚جŒoŒ±‚©‚ç–¾ٹm‚ئ‚ب‚ء‚½‚±‚ئ‚ئ‚µ‚ؤپA”گ¶’nˆو‚جŒµڈd‚ب••چ½پAٹ³ژز‚جٹu—£پAژ€‘ج‚ج‰خ‘’‚ـ‚½‚حٹؤژ‹‰؛‚ج–„‘’پAڈء“إپi‰–‘fپAƒtƒFƒmپ[ƒ‹پAƒNƒŒƒ]پ[ƒ‹پAگخٹD‚ب‚اپj‚حپA—¬چs‚ج”گ¶ژ‚ةژ،—أ‚âگژ،“I‚ب‘خچô‚ئ‹¦’²‚µ‚ؤپA‰qگ¶ڈم‚جٹˆ“®‚ئ‚µ‚ؤ•K—v‚ة‚ب‚éپBژ،—أ‚ة“–‚½‚éژز‚حژ©Œب‚ج—\–h‚¾‚¯‚إ‚ب‚پA•aŒ´‹غ‚ًٹgژU‚µ‚ب‚¢‚و‚¤’چˆس‚ً‘س‚ç‚ب‚¢پi”’ˆك‚â’·ŒCپAƒ}ƒXƒN‚ج’…—pپAگخ‚¯‚ٌپEƒAƒ‹ƒRپ[ƒ‹پE
Javel‰t‚ً—p‚¢‚½ڈء“إپjپBƒpƒjƒbƒN‚ةٹׂء‚½ٹ³ژزپAگعگGژزپA‹^گfژز‚ھ“¦–S‚µ‚½‚èپAژ€‘ج‚ج‰^”ہ‚ھ•ْٹü‚³‚ꂽ‚肵‚ب‚¢—lپAڈ\•ھ”z—¶‚·‚éپBپ@
ƒڈƒNƒ`ƒ“پF—LŒّگ«‚ج”»’è‚ھ–â‘è‚ئ‚ب‚ء‚ؤ‚¢‚éپBƒڈƒNƒ`ƒ“‚ة‚و‚é–ئ‰u‚ح•sڈ\•ھ‚إپA‚P‰ٌ‚ج’چژث‚إ
50پ“پA‚Q‰ٌ‚ج’چژث‚إ60پ“‚جژز‚ھ—\–h‚³‚ê‚é‚ة‰ك‚¬‚¸پA‚»‚جٹْٹش‚à—ک_“I‚ة‚ح‚Uƒ•ŒژپAژہچغ‚ة‚ح‚R-‚Sƒ•Œژ‚ة—¯‚ـ‚ء‚ؤ‚¢‚éپBڈ]‚ء‚ؤپAŒآگl‚ج—\–h‚ة‚ح–w‚اٹٌ—^‚¹‚¸پAڈW’c‚ج—\–h‚ة‘خ‚µ‚ؤ‚àپA‹غ‚ج•غ—Lٹْٹش‚ً’Z‚‚µ‚½‚èپA‹غ‚جٹgژU‚ً–W‚°‚邱‚ئ‚ح‚ب‚¢‚½‚كپAŒّ‰ت‚ة‚حŒہٹE‚ھ‚ ‚éپB‚©‚آ‚ؤپA—¬چsژ‚جƒRƒŒƒ‰ٹ³ژز‚ھ50پ“Œ¸ڈ‚·‚éپA‚ئ‚µ‚½Œ‹‰ت‚ح–³ژ‹‚³‚ê‚é‚ظ‚ا‚ج—لٹO‚إپAƒAƒtƒٹƒJ‚إ‚ج–hˆ³‘خچô‚ةٹض‚ي‚ء‚½ˆمژt‚½‚؟‚جŒ©‰ً‚حپAˆê”ت“I‚بƒڈƒNƒ`ƒ“گعژي‚ح‚P‚آ‚ج—¬چs‚ج’›‚µ‚ًژ~‚ك‚é—ح‚ئ‚ب‚éپA‚ئ‚¢‚¤‚à‚ج‚إ‚ ‚éپB‚آ‚ـ‚è—¬چs’†‚ح’èٹْ“I‚ةƒڈƒNƒ`ƒ“گعژي‚ً‘±‚¯‚ب‚¯‚ê‚خ‚ب‚ç‚ب‚¢‚ي‚¯‚إپA‚µ‚©‚à‚±‚ج•û–@‚إ‚ح‰“‚‚ةژ¾•a‚ھ“`”d‚·‚é‚ج‚ً—}‚¦‚邱‚ئ‚حڈo—ˆ‚ب‚¢پBƒڈƒNƒ`ƒ“‚Pml’†‚ة‚حژ€–إ‚µ‚½‹غ‚ھ1-10‰ٹـ—L‚µ‚ؤ‚¨‚èپA‹اڈٹ‚ئ‘Sگg‚ض‚ج”½‰‚ح‹Hپi”÷”MپAŒ‘‘سپA“ھ’ةپj‚إپAٹ댯‚ح‚ب‚¢پBƒڈƒNƒ`ƒ“‚ح”ç‰؛’چ‚ـ‚½‚ح‹ط’چ‚إ“ٹ—^‚·‚邽‚كپA Ped-O-JetپiƒsƒXƒgƒ‹Œ^کA‘±’چژثٹيپj‚جژg—p‚ھ‰آ”\‚إپA‘هگlگ”‚ةگعژي‚·‚é‚ئ‚«‚ة‘ه•دڈd•َ‚·‚éپB”ç“à’چژث‚ح‘د”Eگ«‚ھ‚و‚èچ‚‚پAƒڈƒNƒ`ƒ“—ت‚ًگك–ٌڈo—ˆ‚é—ک“_‚ھ‚ ‚éپBŒoŒûƒڈƒNƒ`ƒ“‚ح PasteurŒ¤‹†ڈٹ‚إٹJ”’†‚إپA‚Qڈù‚ً‚V“ْ‚¨‚¢‚ؤ‚Q‰ٌ•—p‚·‚éپB–ئ‰uژ‘±ٹْٹش‚ھ‚¸‚ء‚ئ’·‚پA‚و‚èŒّ‰ت‚ھ‚ ‚é‚ئچl‚¦‚ç‚ê‚éپBپ@پ@
•S“ْٹP“إ‘f
pertussis toxinپiPTپjPT
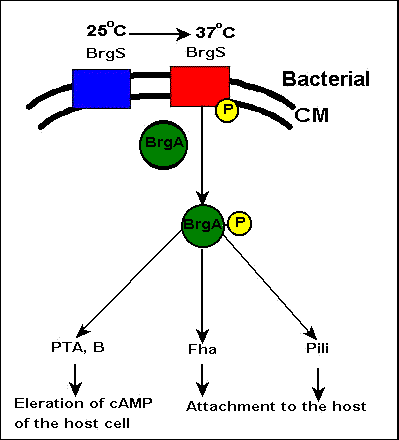
‚حپA•S“ْٹP‹غ‚جٹO•”‚ج‰·“x‚ھ37پژˆبڈم‚ة‚ب‚é‚ئژYگ¶‚³‚ê‚éپB‘ه‹C‚ج•½‹د‹C‰·‚ً–ٌ25پژ‚ئ‚·‚é‚ئپA‚±‚ج‰·“x‚إ‚ح•S“ْٹP‹غ‚جچ×–E–Œ‚ة‘¶چف‚·‚é–Œƒ^ƒ“ƒpƒN‚إ‚ ‚éBvgS‚حٹˆگ«‰»‚µ‚ؤ‚¢‚ب‚¢‚½‚ك‰½‚جŒّ‰ت‚à‚ب‚¢‚ھپAژüˆح‚ج‰·“x‚ھ37پژ‚ج•د‰»‚·‚é‚ئBvgS‚ھژ©“®“I‚ةƒٹƒ“ژ_‰»‚³‚ê‚éپBƒٹƒ“ژ_‰»‚³‚ꂽBvgS‚حپAٹˆگ«‚ة‚ب‚èپAچ×–Eژ؟’†‚ة‘¶چف‚·‚éƒ^ƒ“ƒpƒNژ؟BvgA‚ًƒٹƒ“ژ_‰»‚·‚éپB‚±‚ج‚±‚ئ‚ھپA’¼گع“IپA‚ ‚é‚¢‚حٹشگع“I‚ةBvgSپABvgA,‘@ˆغڈَگشŒŒ‹…‹أڈW‘fFha (filamentous hemagglutinin),گü–رpili‚ج“]ژت‚ًٹˆگ«‰»‚³‚¹‚éپB‚±‚جڈَ‘ش‚ة‚¨‚¢‚ؤپAFha‚ئpili‚جˆâ“`ژq‚ج“]ژت‚ھٹˆگ«‰»‚³‚ê‚é‚ئپA‚»‚ج‚±‚ئ‚ھPT‚ئƒAƒfƒjƒ‹ƒVƒNƒ‰ƒAپ[ƒ[پiAcaseپj‚جˆâ“`ژq‚ًٹˆگ«‰»‚³‚¹پA“إ‘f‚ھژYگ¶‚³‚ê‚é‚ج‚إ‚ ‚éپBپiFig.3ژQڈئپj‚؟‚ب‚ف‚ةپA•S“ْٹP‹غ‚ح‘@–ر‚ًژg‚ء‚ؤ‹Cٹاژxڈم”ç‚ة•t’…‚µپA‚»‚±‚إ‘گB‚·‚éپBپ@
پ@
پ@
2
پD•S“ْٹP“إ‘f‚جچ\‘¢PT
‚حS‚Pپ`S5‚جƒTƒuƒ†ƒjƒbƒg‚ھS4‚ً2Œآ‚à‚آ6Œآ‚جƒTƒuƒ†ƒjƒbƒg‚©‚ç‚ب‚é•ھژq—ت105‚‹‚„‚جƒ^ƒ“ƒpƒN‚إ‚ ‚èپAI‘ٹ‹غ‚©‚ç‹غ‘جٹO‚ض•ھ”ه‚³‚ê‚éپB“إگ«گ¬•ھ‚حS1ƒTƒuƒ†ƒjƒbƒg‚إ‚ ‚èپANADˆث‘¶گ«‚جADP-riposyltransferaseٹˆگ«‚ً—L‚µپAGTPŒ‹چ‡ƒ^ƒ“ƒpƒN‚ج‚P‚آGi(inhibitory G protein)‚ًADPƒٹƒ{ƒVƒ‹‰»‚·‚éپBS1ˆبٹO‚جƒTƒuƒ†ƒjƒbƒg‚ھƒŒƒZƒvƒ^پ[‚ةŒ‹چ‡‚·‚éگ¬•ھ‚إ‚ ‚èپAS2-S4گ¬•ھ‚ئS3-S4گ¬•ھ‚ئ‚ھS5‚ة‚و‚ء‚ؤŒ‹چ‡‚³‚ê‚ؤ‚¢‚éپB Fig.11 •S“ْٹP“إ‘f‚جچ\‘¢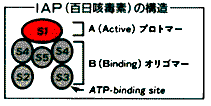
‚RپD•S“ْٹP“إ‘f‚جƒŒƒZƒvƒ^پ[
Fig.12
•S“ْٹP“إ‘f‚ھڈhژهچ×–E“à‚ة“ü‚é‘ه‚ـ‚©‚ب‰ك’ِ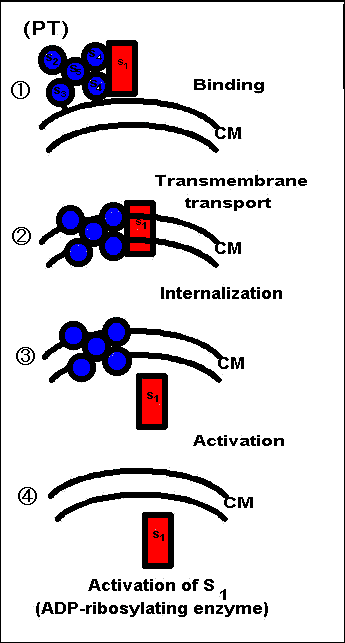
‡@•S“ْٹP“إ‘f‚ھڈhژهچ×–E‚جچ×–E–Œ‚ة“’BپAŒ‹چ‡‚·‚éپB
‡A–Œ‚ً’ت‚µ‚½—A‘—پB
Subunit B‚ھ“إگ«گ¬•ھ‚إ‚ ‚éSubunit AپiS1پj‚ھ–Œ“à‚ة“ü‚邽‚ك‚جٹî“_‚ئ‚ب‚éپB‡B“إگ«گ¬•ھ‚إ‚ ‚é
S1‚ھچ×–E“à‚ةگN“ü‚ةگ¬Œ÷‚µ‚½پBSubunit B‚حچ×–E“à‚ة‚ح“ü‚ç‚ب‚¢پB‡Cچ×–E“à‚إ‚ج”½‰‚ة‚و‚ء‚ؤ“إگ«گ¬•ھ
S1‚ھٹˆگ«‰»‚µ‚ؤPT‚ھ”Œ»‚·‚éپBڈاڈَ‚ئ‚µ‚ؤ‚حƒٹƒ“ƒp‹…‘‘½پA’لŒŒ“œ‚ب‚ا‚ًˆّ‚«‹N‚±‚·پBپ@
‚PپDپj•S“ْٹP“إ‘f‚حچ×–E–Œ•\–ت‚ج
ƒVƒAƒچ’`”’‚ج“œچ½‚ًƒŒƒZƒvƒ^پ[‚ئ‚µ‚ؤچ×–E–Œ•\–ت‚ةŒ‹چ‡‚·‚éپB‚»‚جچغŒ‹چ‡‚·‚é‚ج‚حپASubunit B‚إ‚ ‚éپB‚»‚جŒمپA“إ‘f‚جچ\‘¢‚ة•د‰»‚ھ‹N‚±‚èپA‚QپDپj‚ھ
‹N‚±‚éپB
‚QپDپj
Subunit B‚ةŒ‹چ‡‚µ‚ؤ‚¢‚éSubunit A‚ھچ×–E“à‚ةگN“ü‚·‚éپB‚RپDپjƒWƒXƒ‹ƒtƒBƒhŒ‹چ‡‚ھٹJ—ôٹزŒ³‚µ‚½‚±‚ئ‚ة‚و‚èپA
ƒ`ƒIƒGƒXƒeƒ‹Œ‹چ‡‚ًچى‚邱‚ئ‚ج‚إ‚«‚éٹî‚ًژè‚ة“ü‚ꂽSubunit A‚حٹˆگ«‰»‚·‚éپB
‚SپDپjچ×–E“à‚ج“إگ«”½‰‚ة‚و‚è“إگ«‚ھ”ٹِ‚³‚ê‚éپB
پ@
Fig.14
چ×–E“à‚إ‚ج•S“ْٹP“إ‘f‚ج”½‰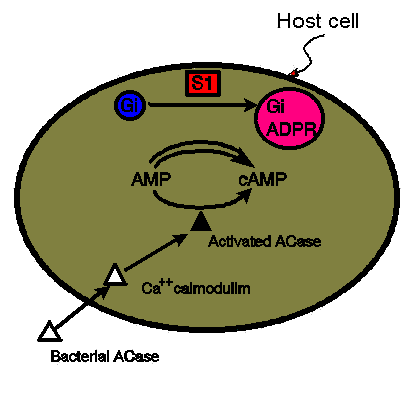 پ@
پ@
•S“ْٹP“إ‘f‚ج
Subunit A‚ھڈhژهچ×–E“à‚ةگi“ü‚·‚é‚ئپAƒAƒfƒjƒ‹ƒVƒNƒ‰پ[ƒ[‚ج•sٹˆگ«‚³‚ًژi‚ء‚ؤ‚¢‚½Gi protein‚ئŒؤ‚خ‚ê‚é“ءژê‚ب‘jٹQGƒ^ƒ“ƒpƒN‚جچy‘f“IADPƒٹƒ{ƒVƒ‹‰»‚ً’‡‰î‚·‚é‚و‚¤‚ة‚ب‚éپBADPپ|ƒٹƒ{ƒVƒ‹‰»‚³‚ꂽGi ƒ^ƒ“ƒpƒNپiADPR-Giپj‚حڈhژهچ×–E‚جƒAƒfƒjƒ‹ƒVƒNƒ‰پ[ƒ[‚جٹˆگ«‰»‚ة‘خ‚·‚é‘jٹQ”\—ح‚ًژ¸‚ء‚ؤ‚¢‚éپBƒAƒfƒjƒ‹ƒVƒNƒ‰پ[ƒ[‚ھٹˆگ«‚ة‚ب‚é‚ئپAAMP‚ح‚ƒAMP‚ة•دٹ·‚³‚êپAٹ´گُ‚µ‚½ڈhژهچ×–E“à‚إ‘‰ء‚·‚éپBچ×–E“à‚ج‚ƒAMP‚ج”Z“x‚ھڈمڈ¸‚·‚é‚ئپAچ×–EٹO•‚ژî‚ً‹N‚±‚µ‚½‚èپAچD’†‹…‚جگH‹غچى—p‚ً‘jٹQ‚·‚é‚و‚¤‚ة‚ب‚éپBپiFig.12پCFig.13ژQڈئپjپ@
•S“ْٹP‚جڈاڈَ
چD””N—î‚ح
2چخˆب‰؛‚إپAگِ•ڑٹْٹش‚ح–ٌ1ڈTٹش‚إ‚ ‚éپB•a‘ش‚ة‚حƒJƒ^ƒ‹ٹْپAلzٹPٹْپA‰ٌ•œٹْ‚ج‚R‚آ‚ج’iٹK‚ھ‚ ‚éپB”Nڈ‚جژq‹ں‚ظ‚ا‚ذ‚ا‚‚ب‚éپB‹غ‚حŒŒ’†‚ض‚حگN“ü‚µ‚ؤ‚±‚ب‚¢‚à‚ج‚جپA‹C“¹‚إ‰ٹڈا‚ً‹N‚±‚µپA‹Cٹاژxڈم”ç‚جگü–ر‚ج“®‚«‚ً—}گ§‚µپA‚»‚جŒ‹‰ت‹C“¹•ھ”ه•¨‚ج’™—¯‚ھ‘‰ء‚·‚éپB‚ـ‚¸پA‹Cٹا‚â‹Cٹاژx‚ھ–`‚³‚êپA‹CٹاپAچA“ھپA•@ˆô“ھ‚ض‚ئٹg‘ه‚·‚éپB1
پjƒJƒ^ƒ‹ٹْپFپ@‚ح‚¶‚ك‚ج‚P
-‚QڈTٹش‚ح•@ڈ`پAŒy‚¢ٹP‚ب‚اٹ´–`‚ئ‹و•ت‚ھ‚آ‚©‚ب‚¢‚ھپAژں‘و‚ةٹP‚ھ‹‚‚ب‚éپB2
پjلzٹPٹْپFپ@’Z‚¢کA‘±‚µ‚½ٹP‚ھپuƒRƒ“ƒRƒ“ƒRƒ“پv‚ئ
5پ`10‰ٌ”چى“I‚ة‘±‚«پiƒXƒ^ƒJƒbƒgپjپA‚»‚جŒمپuƒqƒBپ[پv‚ئ‘§‚ً‹z‚¢چ‚ق”چىپiƒEپ[ƒvپj‚ًŒJ‚è•ش‚·پB‚±‚جŒJ‚è•ش‚µ‚ًƒŒƒvƒٹپ[ƒ[‚ئ‰]‚¢پA•S“ْٹP‚ة“ء—L‚ئ‚³‚ê‚ؤ‚¢‚éپBƒŒƒvƒٹپ[ƒ[‚ح–éٹش‚ة‘ˆ«‚·‚邱‚ئ‚ھ“ء’¥‚إ‚ ‚éپBکA‘±گ«‚جŒƒ‚µ‚¢ٹPڑu‚ھ”چىگ«‚ة‹N‚±‚èپA‘§‚ً‹z‚¤ٹش‚ھ‚ب‚¢‚½‚كپAگأ–¬ˆ³‚جک´گi‚ة‚و‚ء‚ؤٹç–ت‚جچg’ھپAٹللظ•‚ژîپAٹç–ت‚ج“_ڈَڈoŒŒ‹y‚رٹل‹…Œ‹–Œ‚جڈoŒŒ“™‚ھŒ»‚ê‚éپBگVگ¶ژ™ٹْ‚©‚ç“ûژ™ٹْ‘پٹْ‚ة‚©‚¯‚ؤ‚ح“ء—L‚جٹP‚ھŒ©‚ç‚ꂸپA“ث‘R–³Œؤ‹z”چى‚âƒ`ƒAƒmپ[ƒ[”چى‚إŒ»‚ي‚ê‚邱‚ئ‚ھ‘½‚¢پBچ‡•¹ڈا‚ً”؛‚ي‚ب‚¢Œہ‚è””M‚ح‚ب‚¢پBٹPڑu”چى‚ج–³‚¢‚ئ‚«‚ح‘S‚گ³ڈي‚جڈَ‘ش‚إ‚ ‚邱‚ئ‚ھ‘¼‚ج‹C“¹ژ¾ٹ³‚ئˆظ‚ب‚éپB”]ڈا‚ً‹N‚±‚µپAڈd‚¢Œمˆâڈا‚ً‹N‚±‚·‚±‚ئ‚ھ‚ ‚éپB‚±‚جŒƒ‚µ‚¢ٹP”چى‚ج‰ٌگ”‚حژں‘و‚ةŒ¸ڈ‚µ‚ؤ‚‚é‚ھپA‘½‚‚ح‚Qƒ•Œژ’ِژc‚éپB3
پj‰ٌ•œٹْپFپ@
1ڈTٹش‚ظ‚ا‘±‚پBٹP‚ج’ِ“x‚à‰ٌگ”‚àژں‘و‚ةŒy‚‚ب‚èپAŒy‰ُ‚µ‚ؤ‚¢‚‚ھپA1”Nˆب“à‚حٹ´–`‚ب‚ا‚ةœë‚é‚ئ”چىگ«‚جٹP‚ھ”F‚ك‚ç‚ê‚éپBپ@
پ@
ژ،—أپF
1
پj چRگ¶•¨ژ؟‚ج“ٹ—^پBگأ’چ—pƒKƒ“ƒ}ƒOƒچƒuƒٹƒ“پA–ئ‰uƒqƒgƒOƒچƒuƒٹƒ“‚جڈ‰ٹْ’چژث‚ھ—LŒّپB‘پٹْ“ٹ—^‚ھ‘هگط‚إ‚ ‚éپB‚Q
)3ژيچ¬چ‡ƒڈƒNƒ`ƒ“(DPTƒڈƒNƒ`ƒ“پjپA•S“ْٹPƒgƒLƒ\ƒCƒh‚ئگüˆغڈَƒwƒ}ƒOƒ‹ƒ`ƒjƒ“‚©‚ç‚ب‚éگ¬•ھƒڈƒNƒ`ƒ“‚ة‚و‚é—\–hگعژي‚ھ—LŒّ‚إ‚ ‚éپB
پ@
پ@
ƒRƒŒƒ‰“إ‘f‚ئ•S“ْٹP“إ‘f‚جˆل‚¢‚ة‚آ‚¢‚ؤ
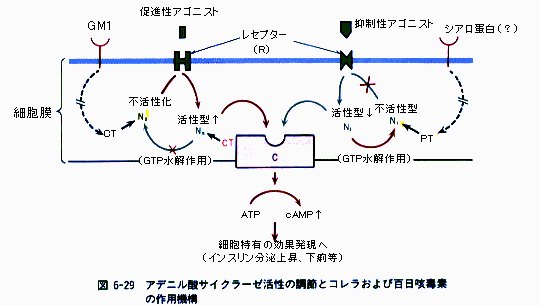
Fig.15
ƒAƒfƒjƒ‹ژ_ƒTƒCƒNƒ‰پ[ƒ[‚ج’²گ®1.
پj—¼•û‚ئ‚àپAڈhژهچ×–E‚جگ³ڈي‚بƒVƒOƒiƒ‹“`’B‚ً–W‚°‚éچy‘f‚إ‚ ‚邱‚ئ‚ة‚ح‚©‚ي‚è‚ح‚ب‚¢پB‚µ‚©‚µپAƒRƒŒƒ‰“إ‘f‚حNADپ{‚©‚çG‚“‚جƒ؟ƒTƒuƒ†ƒjƒbƒg‚ض‚جADPپ|ƒٹƒ{پ[ƒX‚ج“]ˆع‚ًگG”}‚µ‚ؤپAƒ؟ƒTƒuƒ†ƒjƒbƒg‚ض‚جGDPaseٹˆگ«‚ً‘jٹQ‚µپAٹˆگ«‰»ڈَ‘ش‚ً‰i‘±‚³‚¹‚éپB‚»‚جŒ‹‰تپAڈ¬’°ڈم”çچ×–E‚جƒAƒfƒjƒ‹ژ_ƒTƒCƒNƒ‰پ[ƒ[‚جژ‘±“Iٹˆگ«‰»‚ھ‹N‚±‚èپAگ¶گ¬‚µ‚½چ‚”Z“x‚ج‚ƒAMP‚ھپAClپ|پCHCO3پ|گ…‚ًژ‘±“I‚ةڈ¬’°“à‹َ‚ة•ھ”ه‚³‚¹‚éپB
‚±‚ê‚ة‘خ‚µ‚ؤپA•S“ْٹP“إ‘f‚حپAADP-ƒٹƒ{ƒVƒ‹‰»‚ًگG”}‚µ‚ؤپAGDP‚ة‚و‚éGDP‚ة’uٹ·”½‰‚ً‘jٹQ‚µپAGi‚ة‚و‚éƒAƒfƒjƒ‹ژ_ƒVƒNƒ‰پ[ƒ[‚ج‘jٹQ‚ً—}گ§‚·‚éپB
2
پDپjچ\‘¢‚ئ‚µ‚ؤ‘ه‚«‚ˆظ‚ب‚邱‚ئ‚حپAƒRƒŒƒ‰ƒgƒLƒVƒ“‚حSubunit A‚ً2ژي—قژ‚ء‚ؤ‚¢‚é‚ة‘خ‚µپA•S“ْٹP“إ‘f‚حˆê‚آ‚µ‚©ژ‚ء‚ؤ‚¢‚ب‚¢‚±‚ئ‚ھ‚ ‚éپBƒRƒŒƒ‰ƒgƒLƒVƒ“‚حڈhژه‚ئ‚ب‚éچ×–E‚ةگi“ü‚·‚éچغ‚ةپAS-SŒ‹چ‡‚ًSubunit Aٹش‚إچs‚ء‚ؤ‚»‚ê‚ً‰ث‹´‚ئ‚µ‚ؤگi“ü‚·‚é‚ج‚ة‘خ‚µ‚ؤپA•S“ْٹP“إ‘f‚حگi“ü‚µ‚½Œم‚ةS-SŒ‹چ‡‚ًٹJ‚¢‚ؤٹˆگ«‰»‚ج‚ف‚ة—ک—p‚µ‚ؤ‚¢‚éپBپ@
پ@
پ@
ژQچl•¶Œ£
‚PپDپjƒŒپ[ƒjƒ“ƒWƒƒپ[‚جگVگ¶‰»ٹwپiڈمپjپAپi‰؛پj
‚QپDپjˆم‰ب”÷گ¶•¨ٹw
‚RپDپjŒث“cگVچ׋غٹw
‚SپDپjچ×–E‚ج•ھژqگ¶•¨ٹw
‘وژO”إپ@
پ@
ژQچl‚ة‚µ‚½ƒzپ[ƒ€ƒyپ[ƒW‚ج
URL‚PپDپj
http://www.Glycoforum.gr.jp/indexJ.htmlپF“œژ‰ژ؟پA“œƒ^ƒ“ƒpƒN‚ب‚اپA“œ‚ةٹض‚·‚錤‹†‚ھ‚ي‚©‚è‚â‚·‚¢گ}“ü‚è‚إژ¦‚µ‚ؤ‚ ‚éپB
‚QپDپj
http://www.meddean.luc.edu/lumen/DeptWebs/microbio/med/review/b-pert.htm#tentپFƒVƒJƒS‚جLOYOLA‘هٹw‚ج•S“ْٹP‹غپA‚¨‚و‚ر‚»‚ج“إگ«‚ةٹض‚·‚éƒyپ[ƒWپB
‚RپDپj
http://www.amda.or.jp/contents/database/4-4/_index.htmlپF‚½‚¢‚µ‚ؤژg‚ي‚ب‚©‚ء‚½‚ھپAˆê‰‚ج‚¹‚ؤ‚¨‚پBƒRƒŒƒ‰‚ة‚آ‚¢‚ؤپB
‚SپDپj
http://diet.well.oka-pu.ac.jp/microbiology/microbiology-index.htmlپFƒRƒŒƒ‰‹غپA‚¨‚و‚ر“إ‘f‚ة‚آ‚¢‚ؤ”ٌڈي‚ة‚ي‚©‚è‚â‚·‚¢پBˆê”ش‚ج‚¨ٹ©‚كپB
ٹJ‚¢‚½Œم‚إƒOƒ‰ƒ€‰Aگ«’تگ«Œ™‹Cگ«…‹غپi‘ه’°‹غ“™پj‚ًƒNƒٹƒbƒN‚·‚éپB
پ@