侾丏俛宆娞墛僂僀儖僗偺憹怋
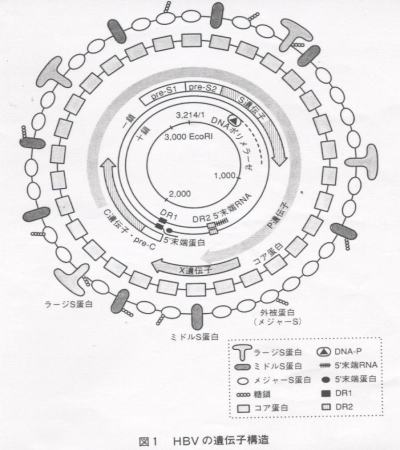
侾亅侾 B宆娞墛僂僀儖僗乮HBV乯偺堚揱巕峔憿
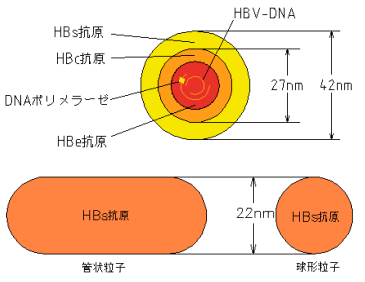
B宆娞墛姵幰偺寣惔拞偵偼宎栺22nm偺彫媴忬棻巕丄嵶挿偄娗忋棻巕偍傛傃栺42nm偺Dane棻巕偑擣傔傜傟傞丅Dane棻巕偑僂僀儖僗偺杮懱偱偁傝丄懠偺棻巕偼僂僀儖僗惗嶻帪偵偮偔傜傟傞忚梋嶻暔偱偁傞丅Dane棻巕撪晹偵偼栺27nm偺僐傾棻巕偑懚嵼偟偰偄傞丅偙偺僐傾棻巕偵偼栺3.2Kb偺娐忬擇杮嵔俢俶俙偑娷傑傟偰偄傞丅乮恾1乯 僂僀儖僗偺mRNA偵懳墳偡傞墫婎攝楍傪桳偡傞DNA嵔傪亅嵔偲偡傞偲丄亅嵔偼僎僲儉挿傪堦廃偟5乫枛抂傪悢墫婎廳暋乮short terminal redundancy乯偟偨偲偙傠偱廔椆偟偰偄傞偑丄暵娐偣偢堦儠強偺愗傟栚乮nick乯傪桳偟偰偄傞丅偙偺short terminal redundancy偼僎僲儉俢俶俙偺娐忬峔憿偺宍惉忋廳梫偲峫偊傜傟偰偄傞丅傑偨亄嵔俢俶俙偺5乫枛抂偼亅嵔偺5乫枛抂偐傜225墫婎棧傟偨偲偙傠偐傜奐巒偡傞偑丄偦偺3乫枛抂偼堦掕偱側偔僎僲儉挿偺栺50~85亾偺娫偱曄摦偡傞丅偮傑傝偙偺僂僀儖僗偼堦晹扨嵔偱偁傞晄姰慡2廳嵔俢俶俙僂僀儖僗偱偁傞丅偙偺僂僀儖僗俢俶俙偺娐忬峔憿偼亅嵔偲亄嵔偺5乫枛抂嬤朤偺晅拝偵傛偭偰傛傝嫮偔堐帩偝傟偰偄傞丅亅嵔俢俶俙偺5乫枛抂偵偼枛抂僞儞僷僋偑嫟桳寢崌偟偰偄傞丅傑偨亄嵔俢俶俙偺5乫枛抂偵偼栺20墫婎偺俼俶俙偑懚嵼偟偰偄傞乮恾1乯丅亄嵔偺3乫枛抂偵偼俢俶俙億儕儊儔乕僛偑懚嵼偟俢俶俙傪恑揥偡傞栶妱傪扴偭偰偄傞丅
偙偺堚揱巕偵偼暘巕検10kD埲忋偺儁僾僠僪偵東栿壜擻側4偮偺open reading frame
(ORF)偑懚嵼偡傞丅偙傟傜偺俷俼俥偼偦傟偧傟HBs峈尨抈敀丄HBc峈尨抈敀,DNA億儕儊儔乕僛丄X抈敀傪僐乕僪偟偰偄傞乮恾1乯丅
HBV DNA偐傜偼彮側偔偲傕4庬椶偺RNA偑揮幨偝傟傞乮恾2乯丅偙傟傜RNA偺揮幨奐巒晹埵偺嬤朤偵偼偦傟偧傟4偮偺僾儘儌乕僞乕椞堟偑懚嵼偡傞丅傑偨丄2庬椶偺僄儞僴儞僒乕椞堟偲1偮偺僌儖僐僐儖僠僐僀僪丒儗僗億儞僔僽丒僄儗儊儞僩偑懚嵼偟丄揮幨挷愡偑峴傢傟偰偄傞乮恾2乯丅
傑偨丄HBV偺墫婎攝楍忋偵偼丄偙傟傜僎僲儉DNA偺5乫枛抂嬤朤偵11墫婎傛傝側傞斀暅攝楍乮direct repeat,DR1偲DR2乯偑懚嵼偡傞丅偙傟傜偺斀暅攝楍偼丄僂僀儖僗偺暋惢傗愼怓懱傊偺慻傒崬傒偵廳梫側栶妱傪壥偨偟偰偄傞偲峫偊傜傟傞丅傑偨丄僐傾堚揱巕偺忋棳偵偼encapsidation signal偑懚嵼偟丄僂僀儖僗偺僷僢働乕僕儞僌偵娭梌偟偰偄傞丅
侾亅俀 俫俛倁偺奺庬俷俼俥偲偦偺嶻暔
倎丏俽堚揱巕
俫俛倁偺昞柺峈尨抈敀傪僐乕僪偟偰偄傞堚揱巕偑丄俽峈尨堚揱巕偱栺226傾儈僲巁傪僐乕僪偟偰偄傞乮恾俁乯丅俽峈尨帺懱偺僐乕僪偡傞抈敀偼丄慳悈惈偺嫮偄抈敀偱僂僀儖僗棻巕昞柺偺庡梫峔憿抈敀偲偟偰儊僕儍乕俽抈敀偲屇偽傟傞丅偙偺俫俛倱峈尨偺庡梫峈尨寛掕婎偱偁傞倎峈尨寛掕婎偼儊僕儍乕俽抈敀偺124亅147斣偺傾儈僲巁偑4偮偺僔僗僥僀儞乮cys乯偵傛傞棫懱峔憿傪偲傞偙偲偵傛傝婯掕偝傟偰偄傞丅HBs峈尨偵偼d乛倷丄 r乛倵偲偄偆僒僽僞僀僾偑懚嵼偡傞偑丄偙傟傜偼儊僕儍乕S抈敀偺偦傟偧傟122斣丄160斣偺傾儈僲巁偑1屄曄堎偡傞偙偲偱曄壔偟摼傞丅 倓乛 倷丄 r乛倵僒僽僞僀僾偼偦傟偧傟偙傟傜偺傾儈僲巁偵傛傝婯掕偝傟傞傕偺偲峫偊傜傟傞丅
恾俁
偙偺HBs堚揱巕偺174傾儈僲巁丄55傾儈僲巁忋棳偵偼2屄偺奐巒僐僪儞偑懚嵼偟偰偄傞丅偙傟傜偵傛傝晅壛偝傟傞儁僾僠僪傪僐乕僪偟偰偄傞椞堟傪丄忋棳懁偐傜偦傟偧傟pre亅S1,
pre亅S2偲屇傫偱偄傞丅乮恾俁乯丅儊僕儍乕S抈敀偵pre亅S1丄pre亅S2椞堟栰偺晅壛偟偨抈敀偼昞柺峈尨偺儅僀僫乕側峔惉惉暘偱偁傝丄偦傟偧傟儔乕僕S,儈僪儖S抈敀偲屇偽傟傞丅偙傟傜pre亅S1,pre亅S2丄儊僕儍乕S抈敀晹暘偵偼摐嵔寢崌晹埵偑懚嵼偟丄偦傟偧傟2庬椶偺億儕儁僾僠僪乮GP42偲P39丄GP36偲P33丄GP27偲P24乯偑懚嵼偡傞丅偙傟傜pre亅S椞堟偺傾儈僲巁偼僋儘乕儞娫偱偺曄堎偺昿搙偑S峈尨撪晹傛傝偐側傝崅棪偱偁傞丅偙傟傜pre亅S1丄pre亅S2儁僾僠僪偼HBs棻巕偺昞柺奜懁偵撍弌偟偰偄傞偲峫偊傜傟傞丅Pre亅S1偼僂僀儖僗偺娞嵶朎傊偺姶愼偵娭梌偡傞偲峫偊傜傟偰偄傞丅Pre亅S2晹暘傕傾儖僽儈儞儗僙僾僞乕傪夘偟偰丄僂僀儖僗偺娞嵶朎傊偺愙拝偵娭學偟偰偄傞壜擻惈偑帵嵈偝傟偨丅嵟嬤pre亅S2晹暘偺寚偗偰偄傞僂僀儖僗偺懚嵼偑妋擣偝傟偰偍傝丄pre亅S2抈敀偑僂僀儖僗偺惗懚偵昁恵偺晹暘偱偁傞偐偵偮偄偰偼媈栤偑掓偝傟傞丅
b.C堚揱巕
HBV棻巕拞偺僐傾棻巕偺峔惉抈敀偱偁傞僐傾棻巕傪僐乕僪偟偰偄傞偺偑HBc堚揱巕偱偁傝丄183傾儈僲巁儁僾僠僪傪僐乕僪偟偰偄傞乮恾4乯丅僐傾抈敀偺傾儈僲巁攝楍偵偼摿挜偑偁傝丄C枛抂嬤朤偼傾儖僊僯儞乮Arg乯偵晉傫偱偄傞丅僐傾抈敀偺C枛抂偺偙偺傛偆側僾儘僞儈儞峔憿偼DNA寢崌抈敀偵傛偔傒傜傟傞峔憿偱偁傝丄僂僀儖僗妀巁偑僐傾棻巕撪偵僷僢働乕僕儞僌偝傟傞偲偒偵昁梫側峔憿偲峫偊傜傟傞丅
恾係
傑偨僐傾堚揱巕偺29傾儈僲巁忋棳偵偼傕偆侾偮偺奐巒僐僪儞偑懚嵼偟丄偙偺椞堟偼pre-C椞堟偲偄傢傟傞丅偙偺pre-C椞堟偵偼慳悈惈偺嫮偄儕乕僟乕僔乕僋僄儞僗偲偄傢傟傞晹暘偑懚嵼偡傞丅偙偺pre-C偍傛傃僐傾椞堟偺抈敀偐傜偮偔傜傟傞儁僾僠僪偐傜丄HBe峈尨抈敀偑嶻惗偝傟傞乮恾係乯丅HBe峈尨抈敀偼壜梟惈偺抈敀偱偁傝丄B宆娞墛偵偼HBe峈尨梲惈婜偲HBe峈懱梲惈婜偑偁傞丅堦斒偵HBe峈尨梲惈婜偵偼僂僀儖僗検偑懡偔丄HBe峈懱梲惈婜偵偼僂僀儖僗検偑彮側偄丅偙傟傑偱偺HBV偺墫婎攝楍偺懡偔偼丄斾妑揑僂僀儖僗検偑懡偔丄僋儘乕儞壔偟偰墫婎攝楍傪寛掕偟傗偡偄丅HBe峈尨梲惈姵幰寣塼拞偺僂僀儖僗傪傕偲偵曬崘偝傟偰偒偨丅嬤擭丄斾妑揑彮検偺僂僀儖僗偟偐懚嵼偟側偄応崌偱傕丄PCR(polymerase chain reaction)朄傪梡偄偰僂僀儖僗傪憹暆偟墫婎攝楍傪寛掕偱偒傞傛偆偵側偭偨偙偲偐傜丄HBe峈懱梲惈椺偵偍偄偰傕HBV偺墫婎攝楍偺夝愅偑梕堈偲側偭偰偒偨丅嵟嬤pre-C椞堟偺戞俀俉斣偺僐僪儞偑掆巭僐僪儞偵曄壔偟丄HBe峈尨偺嶻惗偑偱偒側偄僂僀儖僗曄堎庬偑懚嵼偡傞偙偲偑傢偐偭偨丅
們. P堚揱巕
HBV偵偼撪嵼惈偵DNA億儕儊儔乕僛偑懚嵼偡傞偙偲偑抦傜傟偰偄傞丅HBV DNA偵偼丄HBs峈尨堚揱巕傗HBc堚揱巕偲偼僼儗乕儉傪堎偵偟偨栺俉俁俀傾儈僲巁傪僐乕僪偡傞ORF偑偁傞丅偙偺戝偒側ORF偐傜偼丄儗僩儘僂僀儖僗偺媡揮幨峺慺偲椶帡惈偺偁傞DNA億儕儊儔乕僛乛媡揮幨峺慺偑嶻惗偝傟傞丅偙偺億儕儊儔乕僛丄俼俶倎倱倕俫妶惈晹埵偑懚嵼偡傞丅乮恾俆乯
恾俆
d.倃堚揱巕
倃堚揱巕偵偼栺侾俆係傾儈僲巁偐傜側傞暘巕検栺侾俈倠俢偺抈敀偑僐乕僪偝傟偰偄傞丅倃堚揱巕偐傜偼栺侽丏俋倠倐偺倣俼俶俙偑揮幨偝傟丄倃抈敀偑嶻惗偝傟偙偺倃抈敀偼僩儔儞僗妶惈壔抈敀偱偁傝僄儞僴儞僒乕傗僾儘儌乕僞乕椞堟偲寢崌偟丄奺庬抈敀偺敪尰挷愡傪偡傞偙偲偑柧傜偐偵側偭偰偒偨丅倃抈敀偼僂僀儖僗抈敀偺揮幨偺挷愡傗娞娻敪娻偲偺娭楢偱拲栚偝傟傞丅
侾亅俁 堚揱巕揮幨偺挷愡
HBV僎僲儉偺偼慜弎偟偨傛偆偵係屄偺ORF偑懚嵼偟偰偄傞丅S峈尨抈敀偼2.4kb丄2.1kb倣RNA偵傛傝丄傑偨C峈尨抈敀丄DNA亅P抈敀偼3.5kb偺mRNA,X抈敀偼0丆9kb偺揮幨RNA偐傜東栿偝傟傞丅乮恾俀乯偙傟傜偺揮幨嶻暔偺俆枛抂嬤朤傪専嶕偡傞偙偲偵傛傝丄偦傟偧傟偺倣RNA偵懳墳偡傞4偮偺僾儘儌乕僞乕椞堟偺懚嵼偑柧傜偐偵偝傟偨乮恾俀乯丅僂僀儖僗偺暋惢偵娭梌偡傞栺3.5kb偺僾儘僽儗儉RNA偼僐傾倣RNA偲傎傏摨偠僒僀僘偱傞偑丄僐傾倣RNA偲僺儘僽儗儉RNA偺敪尰晹埵偑傢偢偐偵堎側傞偙偲偑嵟嬤帵偝傟偨丅
傑偨丄HBV偺堚揱巕敪尰傪挷惍偡傞僄儞僴儞僒乕椞堟偑懚嵼偡傞丅嵟嬤丄僄儞僴儞僒乕椞堟偑俀儢強懚嵼偡傞偙偲傗丄僗僥儘僀僪偵傛傝妶惈偑塭嬁偝傟傞僌儖僐僐儖僠僐僀僪丒儗僗億儞僔僽丒僄儗儊儞僩偑懚嵼偡傞偙偲偑柧傜偐偵側偭偨乮恾俀乯丅僄儞僴儞僒乕侾偼X堚揱巕偺忋棳偵丄偝傜偵僄儞僴儞僒乕俀偼pre亅C堚揱巕忋棳偺X堚揱巕屻敿晹偵懚嵼偡傞丅僄儞僴儞僒乕俀偼僸僩娞嵶朎栰摿堎揑偺懚嵼偡傞nuclear factor偲寢崌偟丄揮幨妶惈偑塭嬁偝傟傞丅偙偺揮幨妶惈偑僸僩偺娞嵶朎偵摿堎揑偵側場巕偵傛傝挷愡偝傟傞偙偲偼丄HBV偑僸僩偺娞嵶朎偱偟偐憹怋偱偒側偄偙偲傪徹柧偡傞傕偺偱偁傞丅傑偨丄偙偺僄儞僴儞僒乕椞堟偺傢偢偐側曄堎偵傛偭偰倣RNA偺揮幨偺岠棪傕戝偒偔堎側傞偨傔丄奺庬抈敀傗僾儗僎僲儉RNA偺嵞惗偑戝偒側塭嬁傪庴偗傞偙偲偑梊憐偝傟傞丅
侾乚係丂俫俛倁偺暋惢
HBV偺暋惢夁掱偵偼丄媡揮幨峺慺偵傛傝RNA intermediate傪夘偟偨DNA偑崌惉偝傟傞偲偄偆媡揮幨偺夁掱偑懚嵼偡傞偲偄偆摿挜偑偁傞乮恾6乯丅HBV偼娞嵶朎偵媧拝丄怤擖屻丄嵶朎幙偱扙崚偟丄HBV DNA偼妀偵堏峴偟撪場惈億儕儊儔乕僛偵傛傝擇杮嵔娐忬DNA偲側傝丄暵娐偟偰僗乕僷乕僐僀儖僪DNA傪拻宆偲偟偰嵶朎偺RNA億儕儊儔乕僛偵傛傝3.5kb RNA偑嶻惗偝傟傞丅偙偺僾儗僎僲儉RNA偼嵶朎幙偵堏峴偟丄僐傾棻巕撪偵曪崌偝傟媡揮幨偺拻宆偲側傞丅偦偺僾儗僎僲儉RNA傪拻宆偲偟偰5乫枛抂寢崌抈敀傪僾儔僀儅乕偲偟丄媡揮幨峺慺偵傛傝亅嵔DNA偑宍惉偝傟傞丅摨帪偵僾儗僎僲儉RNA偼媡揮幨峺慺偺桳偡傞RNAseH妶惈偵傛傝暘夝偝傟傞丅
傑偨丄僾儗僎僲儉RNA偺DR1偺5乫枛抂偵巆偭偨RNA傪僾儔僀儅乕偲偟偰丄direct repeat俀攝楍偺壓棳偱+嵔DNA偺恑揥偑5乫枛抂偵摓払偡傞偲亅嵔偺3乫屄偺DNA傊偲拻宆傪曄姺偟丄偝傜偵恑揥偟暵娐擇杮嵔DNA偑宍惉偝傟傞丅亅嵔偍傛傃亄嵔DNA崌惉偺娫偵丄僐傾棻巕偼奜旐偱暍傢傟姰慡側HBV棻巕偲側傝丄娞嵶朎偐傜寣拞傊偲堏峴偡傞乮恾6乯丅HBV偺pre-C椞堟偵廳暋偟偨晹暘偵偼丄墫婎攝楍偑懳傪側偟stem-loop條偺峔憿傪偲傞encapsidation signal 偑懚嵼偡傞丅僾儗僎僲儉RNA偑僐傾抈敀偵寢崌偟僐傾撪晹偵僷僢働乕僕儞僌偝傟傞夁掱偱丄偙偺僔僌僫儖偑昁梫偱偁傞丅偙偺僐儞僼僅儊乕僔儑儞偑幐傢傟傞偲丄僂僀儖僗妀巁偺僐傾棻巕撪傊偺僷僢働乕僕儞僌偑偱偒側偔側傞丅偙偺偨傔偵pre-C椞堟偺曄堎偼偒傢傔偰尷掕偝傟偨晹埵偵偟偐婲偙傜側偄丅
堦曽慜弎偟偨偛偲偔丄僐傾抈敀偺屻敿晹偺椞堟偵偼丄傾儖僊僯儞偵晉傫偩椞堟偑懚嵼偡傞丅偙偺晹暘偼僂傿儖僗偺RNA傗DNA偲寢崌偡傞偙偲偑柧傜偐偵偝傟偨丅偡側傢偪僐傾抈敀偺屻敿晹偼encapsidation signal偑僐傾抈敀偲寢崌偡傞晹埵偲峫偊傜傟傞丅妀巁傪娷傓僐傾棻巕偑偱偒傞偨傔偵偼偙偺椞堟偑昁梫偲峫偊傜傟傞丅
恾俇
俀丏昦尨惈偲柶塽
柶塽擻偑惓忢側惉恖偺応崌丄HBV偺姶愼偼旕帩懕惈姶愼偱偁傝丄懡偔偼晄尠惈姶愼偱偁傞偑丄堦晹偼尠惈偺媫惈B宆娞墛偲側傞丅偟偐偟梊屻偼堦斒偵傛偄丅偙偺応崌丄HBV偺姶愼帺懱偼娞嵶朎傪攋夡偡傞偙偲偼側偄偑丄姶愼嵶朎忋偺HBcAg傗HBeAg傪丄庡偲偟偰CD8梲惈偺嵶朎彎奞惈T嵶朎偑昗揑偲偟偰峌寕偡傞偙偲偵傛偭偰丄娞嵶朎偑彎奞偝傟偰娞墛傪傂偒婲偙偡丅堦曽丄寣拞偵梀棧偟偨HBV偼峈HBs峈懱偵傛偭偰攔彍偝傟傞丅乮恾俈乯
恾俈丂媫惈俛宆娞墛乮旕帩懕惈娞墛乯偵偍偗傞俫俛倁峈尨偲旕俫俛倁峈懱偺徚挿
柶塽擻偑廫暘偱側偄怴惗帣傗梒帣丄偁傞偄偼惉恖偺柶塽晄慡姵幰偺応崌丄HBV偼帩懕惈姶愼傪婲偙偟丄柍徢岓惈HBV僉儍儕傾偲側傞丅偡側傢偪丄忋弎偺柶塽婡峔偑廫暘偵摥偐側偄偺偱丄娞墛傪婲偙偡偙偲偑側偄斀柺丄HBV傕懱撪偐傜攔彍偝傟側偄丅
HBsAg偑俇儢寧埲忋偵傢偨偭偰梲惈偱偁傞応崌傪HBV僉儍儕傾偲掕媊偡傞偑丄偦偺側偐偐傜枬惈娞墛傗娞峝曄偵堏峴偟丄偝傜偵偼尨敪惈娞娻傪敪惗偡傞応崌偑偁傞丅
帩懕姶愼偺弶婜偵偼HBeAg偑梲惈偱偁傝丄偙偺帪婜偺寣塼偵偼懡検偺HBV偑娷傑傟偰偄傞偺偱姶愼惈偑崅偔丄娞忈奞偺敪尰丒恑揥偑傒傜傟傞丅挿偄宱夁偺屻丄寣拞偺HBeAg偼徚幐偟丄戙傢偭偰峈HBe峈懱偑梲惈偵側傞偲丄姶愼椡傕掅壓偟丄柧傜偐側娞忈奞偑弌尰偟側偔側傞丅乮恾俉乯
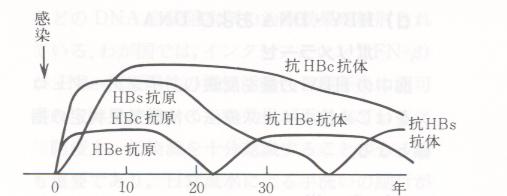
HBV僉儍儕傾偱HBeAg偑梲惈偺曣恊偐傜惗傑傟偨怴惗帣偺懡偔偼HBV僉儍儕傾偲側傞丅
僸僩埲奜偱偼僠儞僷儞僕乕側偳偺楈挿椶偵姶愼偟偆傞偑丄堦斒揑偵寉徢偱偁傞丅
俁丏幚尡幒恌抐
庬庬偺HBV儅乕僇乕傪専嵏偟偨僂僀儖僗妛揑恌抐偍傛傃昦懺偺敾掕傪峴偆丅
a)HBs峈尨偍傛傃HBs峈懱
HBs峈尨梲惈偼HBV偺姶愼偑尰嵼婲偙偭偰偄傞偙偲傪帵偡丅HBs峈懱梲惈偼夁嫀偺姶愼楌偁 傞偄偼儚僋僠儞愙庬楌傪帵偡丅
b)HBc峈懱
崅偄峈懱壙偺HBc峈懱梲惈(捠忢HBs峈尨梲惈)偼尰嵼偺HBV姶愼傪帵偟丄掅偄峈懱壙(捠忢HBs峈懱梲惈)偼夁嫀偺HBV姶愼傪帵偡丅摿偵IgM丒HBc峈懱梲惈偱偁傟偽B宆媫惈娞墛偲恌抐偡傞丅
c)HBe峈尨偲Hbe峈懱
Hbe峈尨梲惈偼寣拞偵懡検偺HBV偑懚嵼偡傞(姶愼惈偑嫮偄)偙偲傪帵偟丄傑偨枬惈妶摦惈娞墛偵偍偗傞HBV偺帩懕揑憹怋偺巜昗偲側傞丅Hbe峈懱偼Hbe峈尨徚幐屻偵梲惈偲側傝丄寣拞偺HBV偑彮側偄(姶愼惈偑掅偄)偙偲傪帵偡丅側偍丄偙偺Hbe峈尨徚幐偲Hbe峈尨弌尰偼seroconversion偲傛偽傟丄preC堚揱巕椞堟偺曄堎偵傛偭偰掆巭僐僪儞偑惗偠Hbe峈尨偺暘斿偑偱偒側偔側傞偙偲偵傛傞丅側偍丄C堚揱巕椞堟偺曄堎偼寑徢娞墛偵娭梌偡傞丅
d)HBV丒DNA偍傛傃DNA億儕儊儔乕僛
寣拞偺HBV偺検傪斀塮偟丄僀儞僞乕僼僃儘儞傪偼偠傔峈僂僀儖僗椕朄偺帯椕岠壥傪敾掕偡傞偨傔偺巜昗偲側傞丅
係丏塽妛
B宆娞墛姵幰偍傛傃俫俛倁僉儍儕傾乕傪姶愼尮偲偟偰丄埲壓偺俁偮偺宱楬丆偡側傢偪 Hbe峈尨梲惈偺曣恊偐傜庡偲偟偰弌嶻帪偵怴惗帣傊偺揱攄丆寣塼傪夘偡傞堛椕峴堊丒擖傟杗丒杻栻偺惷拲側偳丄偦偟偰惈峴堊偵傛偭偰俫俛倁偺姶愼偑婲偙傞丅
俫俛倁偼悽奅揑偵暘晍偡傞偑丄偦偺僉儍儕傾乕偺昿搙偼抧堟偵傛偭偰堎側傝丄摿偵傾僕傾丆傾僼儕僇偵崅偄丅俫俛倁偺僉儍儕傾乕偼慡悽奅偱俁壄恖偲偝傟丄偦偺俋俆亾偼敪揥搑忋崙偵曃嵼偟丄傾僕傾偵栺俀壄俀愮枩恖丆傾僼儕僇偵栺俆愮枩恖偑懚嵼偡傞丅擔杮偱偼俀乣俁亾乮俀侽侽乣俁侽侽枩恖乯偱偁傝丄墷暷偺侾侽攞埲忋偺昿搙偱偁傞丅
俫俛倁僒僽僞僀僾偺暘晍偼丄俫俛倁偺曣帣姶愼偁傞偄偼壠掚撪姶愼傪斀塮偟偰丄抧堟摿堎惈傪帵偡丅偡側傢偪丄俫俛倁偺偆偪拞崙偺墿壨棳堟偱偼俋侽亾埲忋丆堧婒丒懳攏偱侾侽侽亾丆嬨廈杮搚偱偼俋侽亾埲忋偑a倓倰僒僽僞僀僾偱偁傞丅偙傟偵懳偟偰壂撽丒墏旤偺俋侽亾嬤偔丆搶杒抧曽偺俆侽亾偑abw偲偝傟偰偄傞丅偙傟傜偺僒僽僞僀僾偺暘晍偼HBV偺揱攄宱楬丆擔杮柉懓偺婲尮傪帵嵈偟偰偄傞丅
僸僩丆陽帟椶丆捁椶偺偐偔僿僷僪僫僂僀儖僗偺俢俶俙偵偼丄憡摨揑側晹暘偑懚嵼偟偰偄傞丅偙傟傜偑摨堦偺婲尮偵桼棃偡傞偲偡傞偲俫俛倁偼侾乣侾壄擭偵傢偨偭偰恖偲嫟懚偟偰偒偨偙偲偑憐掕偝傟傞丅帠幚丄抧媴忋偵偼栺侾壄俈愮枩恖偺僉儍儕傾偑懚嵼偟丄偦偺戝晹暘偼傾僕傾丆傾僼儕僇偵曃懚偟偰偄傞丅
俆丏梊杊丄帯椕媦傃塽妛
丂俫俛倱峈尨偼姶愼杊屼峈尨偱偁傝丄峈俫俛倱峈懱偼姶愼杊屼峈懱偱偁傞丅偟偨偑偭偰丂峈俫俛倱僸僩柶塽僌儘僽儕儞乮俫俛俬俧乯偵傛傞庴摦柶塽偲丄僉儍儕傾偺寣燋桼棃偺俫丂俛倱偺峈尨傪惛惢偟偨僒僽儐僯僢僩乮僐儞億乕僱儞僩乯俫俛儚僋僠儞乮恾俋乯偁傞偄偼俫俛倱堚揱巕傪僋儘乕僯儞僌偟偰峺曣偵嶻惗偝偣偨慻姺偊俫俛儚僋僠儞乮恾侾侽乯偵傛傞擻摦柶塽偵傛傞梊杊偑壜擻偱偁傞丅丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂
恾俋寣燋偵傛傝惛惢偟偨俫俛倱峈尨
恾侾侽峺曣偑嶻惗偟偨俫俛倱峈尨
丂
丂尰嵼丄俫俛倕峈尨梲惈偺擠晈偐傜惗傑傟偨怴惗帣偵丄偦偺僉儍儕傾壔傪杊巭偡傞栚揑偱丄傑偢俫俛俬俧傪搳梌偟偰曣帣姶愼傪杊偓丄偦偺屻俛宆娞墛僂僀儖僗儚僋僠儞乮俫俛倱峈尨乯傪愙庬偡傞曽朄偑幚巤偝傟偰偄傞丅
丂丂峈僂僀儖僗嵻偲偟偰偼丄價僞儔價儞乮俙倰倎-俙乯側偳偺俢俶俙崌惉慾奞嵻偺帯椕岠壥偑専摙偝傟偰偄傞丅傢偑崙偱偼丄僀儞僞乕僼僃儘儞乮俬俥俶-兝乯偑俫俛倕峈尨梲惈俛宆娞墛偵擣壜偝傟偰偍傝丄峈僂僀儖僗岠壥偑帵偝傟偰偄傞丅
丂丂杊塽忋丄揱愼尮傪廫暘擣幆偡傞偙偲偑傕偭偲傕廳梫偱偁傝丄擔忢棳悈偵傛傞庤愻偄偺椼峴偑桳岠偱偁傞丅徚撆偼幭暒乮侾俆暘乯丄僆乕僩僋儗乕僾丄師垷墫慺巁僜乕僟乮桳岠墫慺擹搙侾侽侽侽乣侾侽侽侽侽倫倫倣乯丄僌儖僞乕儖傾儖僨僸僪塼乮俀亾乯丄僄僠儗儞僆僉僒僀僪乮僈僗乯側偳偵傛傞丅
俀丏儗僩儘僂僀儖僗偲俛宆娞墛僂僀儖僗
1丏儗僩儘僂僀儖僗丂丂乣俢俶俙拞娫懱傪宱偰暋惢偡傞俼俶俙僎僲儉乣丂丂丂
俛宆娞墛僂僀儖僗偼儗僩儘僂僀儖僗偺傛偆偵媡揮幨偵傛偭偰暋惢偝傟傞偺偱偙偙偱偼丄嶲峫偺偨傔偵儗僩儘僂僀儖僗偵偮偄偰弎傋傞丅
儗僩儘僂僀儖僗偼丄廻庡嵶朎偲枾愙側撈摿偺娭學傪傕偭偰偄傞丅僂僀儖僗丒僎僲儉偼+嵔RNA偩偑丄暋惢偺拞娫懱偼僎僲儉傪僐僺乕偟偨擇杮嵔DNA偱丄僾儘僂僀儖僗乮倫倰倧倴倝倰倳倱乯偲傛偽傟傞丅僾儘僂僀儖僗偼嵶朎偺堚揱巕偵帡偰偍傝丄廻庡愼怓懱偵慻傒崬傑傟偰弶傔偰揮幨偺拻宆偲偟偰摥偔丅偦偺偨傔丄怴偟偄僎僲儉偼嵶朎偺婡峔傪偦偺傑傑巊偭偰妀偺拞偱嶌傜傟丄僾儘僙僔儞僌傪庴偗傞丅僂僀儖僗丒僎僲儉偺RNA偼倣RNA偺傛偆偵尒偊傞偑丄姶愼偺弶婜偵偼偦偆偼摥偐偢丄DNA崌惉偺拻宆偲側傞丅偙偺斀墳傪恑傔傞峺慺偼嵶朎偵偼懚嵼偟側偄偺偱丄價儕僆儞偑帩偪崬傓懠側偄丅偙偺峺慺偼媡揮幨峺慺乮倰倕倴倕倰倱倕丂倲倰倎値倱們倰倝倫倲倎倱倕乯偲傛偽傟丄價儕僆儞偵偙偺峺慺偑偁傞偲偄偆偙偲偑儗僩儘僂僀儖僗偺廳梫側摿惈偲側偭偰偄傞丅慻傒崬傑傟偨僾儘僂僀儖僗偺俢俶俙偼揮幨偝傟偰巕懛僎僲儉傪嶌傝丄偙傟偼嵶朎枌偵堏摦偟丄價儕僆儞偵擖傝丄嵶朎傪嶦偡偙偲側偔嵶朎枌偐傜弌夎偟偰偔傞丅儗僩儘僂僀儖僗偺憹怋僒僀僋儖傪柾幃揑偵恾侾侾偵帵偡丅
恾侾侾
儗僩儘僂僀儖僗偼僯儚僩儕偵偑傫傪婲偙偡場巕偲偟偰崱悽婭弶摢偵扨棧偝傟偨丅嵟弶偵尒弌偝傟偨偺偼侾俋侾侾擭偵俹倕倷倲倧値丂俼倧倳倱偑暘棧偟偨儔僂僗擏庮僂僀儖僗乮俼俽倁乯偱丄偑傫傪堷偒婲偙偡場巕偺儌僨儖偲偟偰崱偱傕廤拞揑偵尋媶偝傟偰偄傞丅摦暔偺偑傫傗偄偔偮偐偺昦婥偵偼丄儗僩儘僂僀儖僗偱婲偙傞傕偺偑偁傞丅偛偔嵟嬤丄僸僩偱傕偦偺傛偆側僂僀儖僗偑敪尒偝傟偨丅戞堦偼俫俿俴倁-嘥偱丄斾妑揑傑傟偱偼偁傞偑抳柦揑側俿儕儞僷媴偺偑傫傪堷偒婲偙偡丅戞擇偼俫俬倁乮俫俿俴倁-嘨傑偨偼俴俙倁偲傕傛偽傟傞乯偱丄屻揤惈柶塽晄慡徢岓孮乮僄僀僘乯偺尨場偲側傞丅
儗僩儘僂僀儖僗偺價儕僆儞偼丄惓廫擇柺懱偺僰僋儖僆僉儍僾僔僪偱僄儞儀儘乕僾偵曪傑傟偰偄傞丅偙偺僂僀儖僗丒僎僲儉偼撈摿偱丄擇攞懱偲側偭偰偍傝丄奺價儕僆儞偵偼丄俈乣侾侽倠倐偺摨堦僐僺乕偺僎僲儉偑俀偮擖偭偰偄傞丅擇攞懱偺僎僲儉傪傕偮棟桼偼柧傜偐偱偼側偄偑丄偙偺偍偐偘偱暋惢偵娭偟偰偺懝彎偺廋暅偲崅儗儀儖偺慻姺偊偑婲偙傞丅
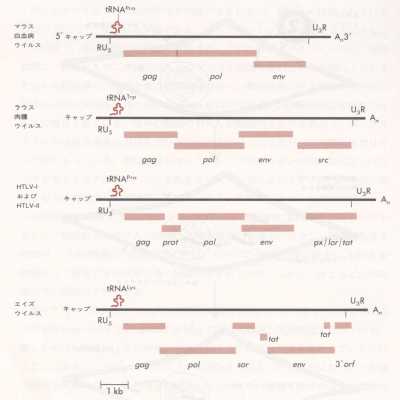
儗僩儘僂僀儖僗丒僎僲儉偺堚揱揑曇惉偼偔傢偟偔傢偐偭偰偍傝丄1僟乕僗傪偙偊傞僂僀儖僗姅偵偮偄偰偦偺慡墫婎攝楍偑寛掕偝傟偰偄傞丅揟宆揑儗僩儘僂僀儖僗偼丄僞儞僷僋幙傪僐乕僪偡傞堚揱巕傪3屄帩偭偰偄傞丅
gag乧[groupspecific antigen乮孮摿堎揑峈尨乯傪僐乕僪偡傞偨傔偙偺柤偑偁傞]偼丄愗抐偝傟傞偲僉儍僾僔僪僞儞僷僋傪惗偠傞億儕僾儘僥僀儞傪僐乕僪偡傞丅
pol乧愗抐傪庴偗偰媡揮幨峺慺偲僾儘僂僀儖僗偺慻傒崬傒偵娭梌偡傞峺慺偵側傞傕偺傪偮偔傞丅
env乧VSV偺G僞儞僷僋傗僀儞僼儖僄儞僓偺HA僞儞僷僋偺傛偆偵僄儞儀儘乕僾偺摐僞儞僷僋偺慜嬱懱傪僐乕僪偡傞丅
偙偺懠偵丄4斣栚偺堚揱巕乮pX,lor,傑偨偼tat偲屇偽傟傞乯偑HTLV-嘥偲嘦偺僎僲儉偺3乫枛抂晹偵嵟嬤尒弌偝傟偨丅偙偺堚揱巕偼尒偐偗忋傾僨僲僂僀儖僗偺E1A僞儞僷僋偵帡偨婡擻傪帵偡揮幨傾僋僠儀乕僞乕傪僐乕僪偡傞傜偟偔丄偦偺嶻暔偼僾儘僂僀儖僗偺敪尰傪挊偟偔憹壛偝偣傞丅
儗僩儘僂僀儖僗偺僎僲儉偺5乫偲3乫枛抂晅嬤偵偼挿偄旕東栿椞堟偑偁傝丄偙偺椞堟偵偼丄暋惢偲揮幨偵昁梫側僔僌僫儖偑娷傑傟偰偄傞丅傑偨丄僎僲儉偺椉抂枛偵抁偄摨曽岦孞傝曉偟攝楍乮R乯偑偁傝丄俆乫枛抂晅嬤偵倲RNA暘巕偑墫婎懳傪宍惉偟偰曐帩偝傟偰偄傞丅僎僲儉偺偙偺晹暘偵偼tRNA偺俁乫晹暘偵憡曗揑側墫婎攝楍偑偁傝丄僾儔僀儅乕寢崌乮PB乯晹埵偲傛偽傟偰偄傞丅tRNA偼暋惢偺夁掱偱廻庡嵶朎偐傜偲傝偙傑傟丄姶愼屻傑傕側偔DNA崌惉偺僾儔僀儅乕偺栶傪偡傞丅媡揮幨峺慺偼DNA億儕儊儔乕僛偺捠椺偲偟偰DNA嵔偺奐巒偼偱偒偢丄俁乫-OH僾儔僀儅乕偐傜嵔傪怢挿偡傞偩偗側偺偱丄偙偺tRNA偼晄壜寚偱偁傞丅
恾侾俀
俀丏僾儘僂僀儖僗偺俢俶俙偵偼媡揮幨峺慺偺摥偒偱挿偄枛抂孞曉偟攝楍偑偱偒傞
嵶朎偵恑擖偟偨儗僩儘僂僀儖僗丒價儕僆儞偺拞偵偼媡揮幨峺慺偑偁傝丄偦傟偑僂僀儖僗偺堦杮嵔RNA暘巕傪拻宆偵擇杮嵔DNA暘巕傪嶌傝丄廻庡嵶朎偺DNA偵慻傒偙傑偣偰RNA億儕儊儔乕僛嘦偵揮幨偝偣傞丅
價儕僆儞偑嵶朎偵恑擖偡傞偲傑傕側偔丄嵶朎幙偱僂僀儖僗DNA偺崌惉偑婲偙傞丅偙偺怴偟偔崌惉偝傟偨堦杮嵔DNA傪丄枛抂偵僾儔僀儅乕tRNA傪寢崌偟偨傑傑擇杮嵔DNA偵曄姺偟側偔偰偼側傜側偄丅偙偺偨傔偵丄RNA偺U3偺偡偖嵍懁偵摿堎揑僯僢僋偑嶌傜傟傞丅偙偆偟偰偱偒偨RNA偺3乫-OH枛抂偑丄崱搙偼+嵔DNA崌惉偺僾儔僀儅乕偲側傞丅
恾侾係
僾儘僂僀儖僗偺俢俶俙傪崌惉偡傞夁掱偼丄偡傋偰媡揮幨峺慺偑峴偆丅偙偺峺慺偼丄偙偺偨傔偵彮側偔偲傕係偮偺妶惈傪帵偝側偔偰偼側傜側偄丅俼俶俙傪拻宆偲偟偨D俶俙崌惉丆俼俶俙亅俢俶俙僴僀僽儕僢僪拞偺俼俶俙偺暘夝丆俢俶俙傪拻宆偲偟偨俢俶俙偺崌惉丆倀3偺5乫枛抂偵偁傞俼俶俙偺摿堎揑愗抐偱偁傞丅偙偆偟偰偱偒偨慄忬俢俶俙偼妀偵塣偽傟丄偙偙偱嵶朎偺峺慺偵傛傝椉枛抂偑楢寢偝傟丄嫟桳寢崌偱丄暵偠偨娐忬暘巕偵側傝丄慻傒崬傒偺慜嬱懱偲側傞丅僂僀儖僗偺俢俶俙偺慻崬傒偺婡峔偼丄姰慡偵傢偐偭偰偄側偄丅慻崬傑傟偨僾儘僂僀儖僗偺枛抂偼偄偮傕摨偠側偺偱娐忬暘巕偼摿堎揑晹埵偱奐娐偝傟傞偵堘偄側偄丅偙傟偵懳偟偰丄慻崬傒傪庴偗傞嵶朎偺俢俶俙偺晹埵偵偼墫婎攝楍偺摿堎惈偑側偄丅僂僀儖僗偲嵶朎偺俢俶俙偺寢崌揰偱偼昁偢丄2墫婎偑僾儘僂僀儖僗偺椉枛抂偐傜彍嫀偝傟丄偝傜偵慻崬傒晹埵偲偟偰巊傢傟偨嵶朎偺俢俶俙偑4乣6墫婎廳暋傪婲偙偟偰偄傞丅偙偺夁掱偼廫暘偵棟夝偝傟偰偄側偄偑丄彮側偔偲傕僂僀儖僗偺僀儞僥僌儔乕僛偲屇偽傟傞僄儞僪僰僋儗傾乕僛偑丄偙偺夁掱偵昁恵偱偁傞丅
僾儘僂僀儖僗偼丄偄偭偨傫嵶朎偺俢俶俙偵慻崬傑傟傞偲廻庡偺俢俶俙偲偲傕偵埨掕偵暋惢偝傟傞丅僶僋僥儕僆僼傽乕僕兩側偳偲偼堎側傝丄僾儘僂僀儖僗偑慻崬傒晹埵偐傜愗傝弌偝傟傞偙偲偼側偄丅偨偩偟丄寚幐傪婲偙偟偰幐傢傟偰偟傑偆偙偲偼偁傞丅儗僩儘僂僀儖僗偺姶愼偼捠忢偼嵶朎偵奞傪梌偊偢丄姶愼嵶朎偼暘楐傪懕偗丄慻崬傑傟偨僾儘僩僂僀儖僗偼偦偺俼俶俙偺崌惉傪巜帵偡傞拻宆偲偟偰摥偔偺偱偁傞丅椺奜偼僄僀僘僂僀儖僗偱丄偙偺僂僀儖僗偼壗傜偐偺棟桼偱姶愼偟偨摿堎揑僿儖僷乕俿儕儞僷媴廤抍傪嶦偟偰偟傑偆丅姶愼傪庴偗偨屄懱偺柶塽擻偑壓偑傞偺偼丄僿儖僷乕俿嵶朎偑屚妷偟偰偟傑偆偨傔偱偁傞丅
恾侾俆
俁丏俴俿俼偐傜僾儘僂僀儖僗揮幨偺巜椷偑弌偝傟傞
LTR偼慻傒崬傒偺枛抂傪嫙媼偡傞偩偗偱側偔丄揮幨僔僌僫儖偺扴偄庤偱傕偁傞丅偙偺僔僌僫儖偼嬌傔偰岠棪揑偱丄偁傞庬偺儗僩儘僂僀儖僗偱偼姶愼嵶朎偺mRNA偺検偺10%偵払偡傞僂僀儖僗崌惉偑婲偙傞丅LTR偺U俁晹暘偵偼丄揮幨偺奐巒傪挷愡偡傞墫婎攝楍偑偁傞丅揟宆揑TATA攝楍偲CCAAT攝楍偑丄U俁-R楢寢揰偵偁傞僉儍僢僾晹埵偐傜偦傟偧傟栺25墫婎偲80墫婎忋棳偵擣傔傜傟傞(恾侾俇)丅偝傜偵忋棳偵偼揮幨偺僄儞僴儞僒乕偑偁傝丄懡偔偺応崌70乣100墫婎偺摨曽岦孞傝曉偟攝楍偲偟偰懚嵼偟偰偄傞丅儗僩儘僂僀儖僗偺僄儞僴儞僒乕偼SV40偺僄儞僴儞僒乕偵帡偰偍傝丄屻幰偲抲偒姺偊傜傟傞傕偺傕偁傞丅
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂恾侾俇
DNA僂僀儖僗偲摨條偵丄慻傒崬傑傟偨僾儘僂僀儖僗偐傜RNA億儕儊儔乕僛嘦偱揮幨偝傟偰RNA偑惗偠傞偲丄嵶朎偺婡峔傪棙梡偟偰僾儘僙僔儞僌傪庴偗傞丅偙偺揮幨嶻暔偼R偺3乫枛抂偱愗抐偝傟偰億儕傾僨僯儖壔偝傟丄偦偺堦晹偼妀偐傜嵶朎幙偵塣偽傟偰弌夎偡傞價儕僆儞偺拞偵擖傝崬傒丄怴偟偄僂僀儖僗丒僎僲儉偵側傞丅巆傝偼嵶朎幙偱gag,pol堚揱巕偺mRNA偲偟偰摥偔(恾侾俈)丅偝傜偵堦晹偺RNA偼僗僾儔僀僔儞僌傪庴偗丄env(偍傛傃僂僀儖僗偵傛偭偰偼pX/lor堚揱巕)偺mRNA偵側傞丅
丂丂丂丂丂丂丂丂丂丂恾侾俈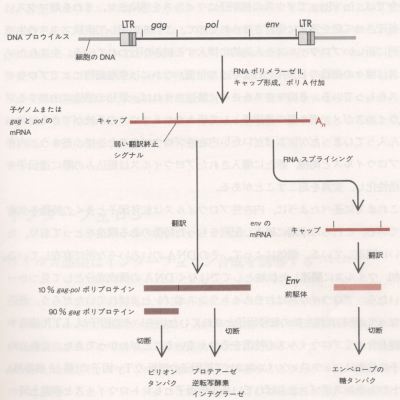
係丏僾儘僂僀儖僗偼堚揱巕偺堦堳偲偟偰惗怋宯楍偺拞偵掕拝偱偒傞儗僩儘僂僀儖僗偼姶愼場巕偲偟偰偩偗偱側偔丄嵶朎偺堚揱巕偲偟偰憹怋偡傞偙偲傕偱偒傞丅偨偲偊偽僂僀儖僗偑惗怋嵶朎(惛巕傑偨偼棏嵶朎偵側傞梊掕偺嵶朎)偵姶愼偡傞偲丄偦偙偱偱偒偨僾儘僂僀儖僗偼偁偨偐傕嵶朎偺惓忢堚揱巕偱偁傞偐偺傛偆偵巕懛偵庴偗宲偑傟偰偄偔丅偙傟偼撪嵼惈僾儘僂僀儖僗(endogenous provirus)偲屇偽傟丄偦偺幚嵼偑徹柧偝傟偰偍傝丄幚嵺偵僸僩傪娷傓愐捙摦暔偺DNA拞偵梕堈偵専弌偝傟傞丅儅僂僗側偳偵偼壗愮傕偺撪嵼惈僾儘僂僀儖僗偑偁傝丄偙偺摦暔偺慡DNA偺0.5%偼撪嵼惈僾儘僂僀儖僗偩傠偆偲悇掕偝傟偰偄傞丅
撪嵼惈僾儘僂僀儖僗偼捠忢偼揮幨偝傟側偄偑丄奜偐傜姶愼偟偰偔傞儗僩儘僂僀儖僗偺僾儘僂僀儖僗偲摨偠峔憿傪傕偮丅側偐偵偼丄嵶朎傪僽儘儌僨僆僉僔僂儕僕儞(BudR)傗儓乕僪僨僆僉僔僂儕僕儞(IudR)側偳偺壔妛暔幙偱張棟偡傞偲姶愼惈僂僀儖僗偺惗嶻偑桿敪偝傟傞傕偺傕偁傞丅撪嵼惈僾儘僂僀儖僗偑揮幨偝傟側偄尨場偺1偮偼丄偦偺撪晹偺CG攝楍晹暘偑峀斖偵儊僠儖壔偝傟偰偄傞偨傔偱偁傞丅桿敪帋栻偼偟偽偟偽偙偺儊僠儖傪奜偡丅
奜場惈儗僩儘僂僀儖僗摨條丄撪嵼惈僾儘僂僀儖僗偼愼怓懱DNA偺儔儞僟儉側埵抲偵慻傒崬傑傟偰偄傞丅屄懱偑堘偊偽僾儘僂僀儖僗偺埵抲傕堘偆偙偲偑懡偔丄撪嵼惈僾儘僂僀儖僗偼斾妑揑嵟嬤偵惉偭偰惗怋宯楍偵摫擖偝傟偨傕偺偲巚傢傟傞丅偲偒偵偼僾儘僂僀儖僗偺憓擖偑堚揱巕傪晄妶惈壔偟偰偟傑偄昞尰宆傪曄壔偝偣傞偙偲傕梊憐偝傟丄彮側偔偲傕偦偺傛偆側曄堎偑1椺丄儅僂僗偺d堚揱巕攝嵗偱抦傜傟偰偄傞丅偦偺曄堎傪婲偙偟偨儅僂僗偺栄偼撈摿偺扺妼怓偱丄堦孮偺嬤岎宯儅僂僗偵偙偺怓偼摿挜揑偵傒傜傟傞丅D曄堎偐傜暅婣偟偨摦暔偼栄偺怓偵傛偭偰梕堈偵専弌偱偒傞偑丄偙傟傜偼僾儘僂僀儖僗傪寚幐偟偰偍傝丄偦偺弌尰昿搙偼悽戙偁偨傝栺3亊10-俇偱偁傞丅
崱偱偼in vitro 偱儅僂僗偺弶婜泱偵僂僀儖僗傪姶愼偝偣丄偦傟傪梇儅僂僗偵嵞拝彴偝偣偰泱傪惓忢偵敪堢偝偣傜傟傞偺偱丄偙傟傪墳梡偟偰幚尡儅僂僗偺惗怋宯楍偵怴偟偄僾儘僂僀儖僗傪恖堊揑偵憓擖偡傞帋傒偑側偝傟偰偄傞丅
偙傟傑偱弎傋偨傛偆偵丄撪嵼惈僾儘僂僀儖僗偼揮堏場巕偲懡偔偺摿挜傪嫟桳偟偰偄傞丅偙傟傜偼枛抂偵孞傝曉偟攝楍傪帩偭偨摿挜偺偁傞峔憿傪偲偭偰偍傝丄屳偄偵娭楢偟偰偄傞丅屄懱偵傛偭偰偦偺DNA偺偄傠偄傠側強偵懚嵼偟偰偄傞丅嵟嬤偵側偭偰丄摉弶恀妀惗暔偺揮堏場巕偲偝傟偰偄偨偄傠偄傠偺場巕偑丄LTR峔憿傗婡擻傕娷傔偰僾儘僂僀儖僗偺摿挜傪側偧傜偊偰偄傞偙偲偑傢偐偭偰偒偨丅偙傟傜偺場巕偺戙昞偼僔儑僂僕儑僂僶僄偺僐僺傾條場巕傗峺曣偺Ty場巕偱儗僩儘僩儔儞僗億僝儞偲傛偽傟偰偄傞丅椉場巕偲傕儗僩儘僂僀儖僗偲帠幚忋摨堦偺婡峔偱廳暋偟憓擖傪婲偙偡偙偲偑徹柧偝傟偰偍傝丄偍偦傜偔桞堦堎側傞偺偼嵶朎奜僺儕僆儞偵側傜側偄偲偄偆揰偩偗偱偁傞丅
俆丏B宆娞墛僂僀儖僗偼DNA僂僀儖僗偩偑儗僩儘僂僀儖僗偺傛偆側暋惢傪偡傞
B宆娞墛僂僀儖僗偼僄儞儀儘乕僾偺偁傞偪偄偝側DNA僎僲儉傪帩偮僂僀儖僗偱丄儗僩儘僂僀儖僗偺棤曉偟偺傛偆側撈帺偺條幃偱暋惢偡傞丅
B宆娞墛僂僀儖僗偺僎僲儉偼娐忬偩偑丄2杮偺DNA嵔偼偦傟偧傟慄忬偱偁傞丅乮恾侾俉乯亅嵔乮傑偨偼挿偄偙偲傪昞偡偨傔偵L嵔偲偄偆乯偼慡僎僲儉傪僇僶乕偡傞挿偝偱丄椉枛抂偺娫偺僊儍僢僾晹暘偼棧傟偰偟傑傢側偄傛偆偵偦偺憡曗嵔亄嵔乮傑偨偼抁偄偙偲傪昞偟S嵔乯偵傛偭偰偮側偓偲傔傜傟偰偄傞丅亅嵔偺俆乫枛抂偵偼僞儞僷僋幙偑嫟桳偟偰偄傞丅僺儕僆儞偵擖偭偰偄傞亄嵔偼偝傑偞傑側挿偝偱崌惉偑偲傑偭偰偄傞偺偱丄偦偺俆枛抂偼堦掕偩偑俁枛抂偼僺儕僆儞偛偲偵堘偭偰偍傝丄巆傝偼僊儍僢僾偵側偭偰偄傞丅僰僋儗僆僉儍僢僾僔僪偺僐傾撪偵DNA億儕儊儔乕僛偑偁傝丄偙偺晄姰慡側嵔偺俁枛抂傪怢挿偡傞丅
恾侾俉乮恾俀係乚俁俀乯
B宆娞墛僂僀儖僗偵姶愼偟偨嵶朎偵偼丄亄嵔偲懳崌偟偰偄側偄亅嵔偑懡検偵娷傑傟偰偄傞偑丄偦偺懡偔偼姰慡側僎僲儉偺戝偒偝偵払偟偰偄側偄丅亅嵔偼枹弉側僐傾忬棻巕偺拞偱RNA傪拻宆偲偟偰崌惉偝傟丄偦偺拻宆偼崌惉偺恑峴偵偮傟偰暘夝偝傟傞丅B宆娞墛僂僀儖僗偼丄偪傚偆偳儗僩儘僂僀儖僗偺傛偆偵媡揮幨偵傛偭偰暋惢偡傞偺偱偁傞丅亅嵔崌惉偺拻宆偲側傞偺偼姰慡側挿偝偺RNA偱丄僾儗僎僲儉乮pregenome乯偲傛偽傟傞丅偙偺暋惢僒僀僋儖偺徻嵶偼傑偩夝柧偝傟偰偄側偄偑丄B宆娞墛僂僀儖僗偵偮偄偰峫偊傜傟傞婡峔傪恾侾俋偵偟傔偡丅儗僩儘僂僀儖僗偲堎側傝丄亅嵔偺奐巒偵偼俆枛抂偵嫟桳寢崌偟偨僞儞僷僋幙偑娭梌偡傞傜偟偔丄偙偺揰偼傾僨僲僂僀儖僗偵帡偰偄傞丅亄嵔偺崌惉偼丄梀棧偺亅嵔傪拻宆偲偟偰婲偙傝丄偦偺嵺偵亄嵔偵憡摉偡傞RNA抐曅傪僾儔僀儅乕偲偟偰梡偄傞傜偟偄丅
恾侾俋乮恾俀係乚俁俁乯
乮嶲峫乯僂僀儖僗娞墛丂摿偵俠宆媦傃俛宆枬惈娞墛帯椕偺嵟怴忣曬
嶲峫帒椏偲偟偰丄俛宆娞墛帯椕偺尰忬偵偮偄偰丄掗嫗戝妛堛妛晹撪壢嫵庼丂嶰戭榓旻巵偺島墘夛偺儗億乕僩傪宖嵹偡傞丅
俛宆娞墛偵偮偄偰
丂俛宆娞墛僂傿儖僗偺姶愼偼丄俠宆娞墛僂傿儖僗偲摨偠傛偆偵寣塼傪夘偡傞姶愼偱偡偑丄俛宆娞墛偵娭偟偰偼桝寣屻娞墛偲偄偆偺偼尰嵼奆柍偲偄偭偰傛偄傜偄偵側偭偰偄傑偡丅尰嵼傓偟傠栤戣偵側傞偺偼惈岎徛丄晇晈娫姶愼偱偡丅偦傟偵傛傞姶愼偑懡偔側偭偰偄傑偡丅偟偐偟丄俠宆娞墛偑擭楊傪栤傢偢偵偡傋偰偺擭楊憌偱僉儍儕傾壔偡傞偺偵懳偟偰丄俛宆娞墛偼庡偵曣巕娫姶愼偑庡側儖乕僩偵側偭偰偄傑偡丅俛宆娞墛僂傿儖僗偑僉儍儕傾壔偡傞偐偟側偄偐偲偄偆偺偼丄僂傿儖僗偺姶愼擭楊偵娭學偑偁傝傑偡丅惗傑傟偰俁嵨埵傑偱偺娫偱偡偲姶愼偟偰僉儍儕傾壔偟傗偡偄忬嫷偑偁傝傑偡丅堦曽丄戝恖偵側偭偰偐傜偼姶愼偟偰傕丄柶塽晄慡偺恖埲奜偼丄摿暿偺帯椕傪偣偢偵帺慠宱夁偱帯偭偰偟傑偆偲偄偆摿挜偑偁傝傑偡丅
晛捠俛宆枬惈娞墛偲偟偰帯椕偺懳徾偵側傞偺偼丄傎偲傫偳偑曣巕娫姶愼偁傞偄偼彫偝偄偲偒偺姶愼偺働乕僗偱偡丅俛宆枬惈娞墛偵娭偟偰偼寢峔帺慠帯桙偑偁傝傑偡丅曣巕娫姶愼偟偨巕嫙傪傒偰傕丄傎偲傫偳偺徢椺偑梒抰墍偁傞偄偼彫妛峑偔傜偄偵娞墛傪婲偙偟偰僂傿儖僗偑尭偭偰丄僂傿儖僗傪帩偭偰偄傞偗傟偳傕傕偆娞墛偼婲偙傜側偄偲偄偆忬嫷偑傎偲傫偳偱偡丅偟偐偟丄偦偆偄偆彫偝偄偲偒偵帺慠偵娞墛傪婲偙偡婡夛偑側偐偭偨恖偵娭偟偰偼嵨偲偲傕偵丄侾侽嵨偁傞偄偼俀侽嵨偲側偭偰傕堦掕偺昿搙偱俛宆枬惈娞墛偼帺慠宱夁偱帯偭偰偟傑偆偙偲偑偁傝傑偡丅嵟廔揑偵偼戝懱俀侽亾埵偺丄俛宆娞墛僂傿儖僗傪偄偭傁偄帩偭偨枬惈娞墛偺恖傪撪壢偱帯椕偟偰偄傞偺偱偼側偄偐丄媡偵尵偊偽僉儍儕傾壔偟偰傕俉侽亾埵偺恖偑帺慠宱夁偱擭乆僂傿儖僗偑彮側偔側偭偰椪彴揑偵偼帯偭偰偟傑偄傑偡丅僉儍儕傾偺俀侽亾埵偺恖偑帯椕偺懳徾偵側傞偲偄偆偙偲偱偡丅
丂僂傿儖僗偵懳偟偰変乆偑帩偭偰偄傞柶塽墳摎偑妶敪偵摥偄偨偑丄僂傿儖僗傪攔彍偟偒傟偢偵帯桙偟側偐偭偨恖偑枬惈娞墛偲偟偰変乆偺栻暔偵傛傞帯椕偺懳徾偵側偭偰偄傑偡丅俛宆枬惈娞墛偺応崌丄偳偪傜偐偲尵偊偽柶塽墳摎偑栚妎傔偰娞墛偑偼偭偒傝婲偙偭偰偔傞偲丄俧俷俿丄俧俹俿偑忋偑傝壓偑傝偟偰偒傑偡丅傂傫傁傫偵俧俷俿丄俧俹俿偺崅抣偑孞傝曉偡帠懺偵側傝傑偡偲丄慻怐妛揑偵偳傫偳傫恑峴偟偰偟傑偆応崌偑偁傝傑偡丅悢擭偱娞峝曄傑偱恑峴偟偰偟傑偆偙偲傕偁傝傑偡丅傗偼傝丄俠宆娞墛僂傿儖僗偲偺堘偄偵傛偭偰柶塽墳摎偺堘偄偑惗偠偰偄傞偐傜偩傠偆偲巚偄傑偡丅寑徢娞墛偼柶塽墳摎偑旕忢偵偑傫偽偭偰丄偑傫偽傝偡偓偰娞憻偑傑偄偭偰偟傑偆昦婥偱偡偑丄柶塽墳摎偑揔搙偵嶌摦偟傑偡偲帺慠帯桙傕廫暘婲偙傝摼傑偡丅偟偐偟丄堦斒偵俛宆枬惈娞墛偺応崌偼丄晛捠偼HBs峈尨傪偺偙偟偰僂傿儖僗偑嬌抂偵彮側偔側偭偰椪彴揑偵帯傞偲偄偆偺偑尨懃偱偡丅
俛宆娞墛僂僀儖僗乮僄儞僇儖僞傛傝乯乮忋恾乯偲偦偺峔憿乮壓恾乯
俛宆娞墛偺帯椕偵偮偄偰
丂俛宆娞墛偺帯椕偵偮偄偰傕偍榖偟偟偨偄偲巚偄傑偡丅俛宆娞墛偼僉儍儕傾偺恖偼偍偦傜偔俀侽侽枩恖埲忋偄傑偡偑丄愭掱偍榖偟偟傑偟偨傛偆偵幚嵺偼帺慠宱夁偱僂傿儖僗偼帩偭偰偄傞偗傟偳傕椪彴揑偵偼帯偭偰偄傞恖偑俉侽亾埲忋偄傑偡丅僂傿儖僗偑偄傞偐傜偲偄偭偰丄偡偖偵帯椕偺懳徾偵偼側傝傑偣傫丅尰嵼丄俛宆娞墛偺帯椕偵娭偟傑偟偰偼丄尨場椕朄偲尵偭偰傕俫俛倱峈尨偑堿惈偵側傞偙偲偼側偐側偐婜懸偱偒傑偣傫偑丄寣塼拞偺僂傿儖僗傪帩懕揑偵嬌抂偵壓偘傞偙偲傪栚昗偵偟偰帯椕偟傑偡丅
丂懳徢椕朄偲偟偰偼嫮椡僱僆儈僲僼傽乕僎儞俠傗僂儖僜傪巊偆偺偼俠宆娞墛偺応崌偲摨偠偱偡丅俛宆娞墛偼僀儞僞乕僼僃儘儞偼昁偢偟傕摿岠栻偲偼尵偊傑偣傫丅尰嵼俛宆娞墛偱僂傿儖僗傪壓偘傞壜擻惈偺偁傞帯椕朄偲偟偰偼丄僗僥儘僀僪偺棧扙椕朄偑偁傝傑偡丅宱岥偺暃恡旂幙儂儖儌儞偱偡丅偦偺棧扙椕朄偲僀儞僞乕僼僃儘儞椕朄偑尰嵼傑偱偺戙昞揑側帯椕朄偱偡丅偟偐偟丄僀儞僞乕僼僃儘儞傪搳梌偟傑偡偲僂傿儖僗偼椙偔壓偑傝傑偡丅偟偐偟尰忬偱偼僀儞僞乕僼僃儘儞偼曐尟忋係廡娫偺帯椕偑尨懃偱偡丅係廡娫偺帯椕偱偼廫暘偱側偄偺偱丄俇乣俈儢寧巊偭偰帯椕偟偰偄傑偡丅偟偐偟丄僀儞僞乕僼僃儘儞扨撈帯椕偵偣傛丄僗僥儘僀僪棧扙椕朄偵偣傛丄偁傞摿掕側昦懺偺俛宆枬惈娞墛偺恖偟偐廫暘側岠壥偑婜懸偱偒傑偣傫丅帯椕偺懳徾幰偑尷掕偝傟偰偟傑偆偺偑戝偒側栤戣偱偡丅
丂僗僥儘僀僪棧扙椕朄偼僾儗僪僯儞偲偄偆暃恡旂幙儂儖儌儞傪侾擔俁侽mg暈梡偟傑偡丅偦傟傪俁廡娫偐傜係廡娫懕偗偰枅擔暈梡偡傞曽朄偲丄侾擔俁侽mg偐傜僗僞乕僩偟偰俀侽mg丄偦偟偰侾侽mg偲侾廡娫枅偵侾侽mg偯偮尭傜偟偰俁廡娫偱廔椆偡傞慟尭椕朄偲偑偁傝傑偡丅暃恡旂幙儂儖儌儞偺暈梡傪奐巒偟傑偡偲俛宆娞墛偺応崌偵偼僂傿儖僗偑憹偊偰偒傑偡丅偼偠傔偼堦帪揑偵丄俧俷俿丄俧俹俿偑壓偑傝傑偡偑僂傿儖僗偼妋幚偵憹偊偰偒傑偡丅偦偟偰俁廡娫偐傜係廡娫暈梡偟偰撍慠暈梡傪拞巭偟傑偡丅憹偊偨僂傿儖僗偵懳偟偰柶塽墳摎偑婲偙偭偰娞墛傪婲偙偟偰丄俧俷俿丄俧俹俿偑偁偑偭偰偒傑偡丅偦偆偟偰暈梡廔椆屻俧俷俿丄俧俹俿偺僺乕僋傪寎偊丄傑偨壓偑偭偰偒傑偡丅暈梡拞巭屻侾儢寧屻埵偑懡偄偺偱偡偑丄偦偺帪偐傜係廡娫僀儞僞乕僼僃儘儞傪枅擔帯椕偡傞曽朄偱偡丅僗僥儘僀僪扨撈帯椕偺応崌偼丄娞墛傪壗夞偐孞傝曉偟婲偙偡偙偲偵傛傝丄僂傿儖僗傪尭彮偝偣偰娞墛傪椙偔偡傞偲偄偆偺偑僗僥儘僀僪棧扙椕朄偱偡丅帯椕慜偺俧俷俿丄俧俹俿偑侾侽侽埲忋丄偱偒傟偽俀侽侽埲忋偵娞墛偑婲偙偭偰偄傞恖偵偙偺僗僥儘僀僪棧扙椕朄偺椙偄揔墳偑偁傝傑偡丅僂傿儖僗傪憹傗偟傑偡偐傜丄帯椕慜偺僂傿儖僗検偑偁傑傝懡偔側偄姵幰偝傫偑懳徾偵側傝傑偡丅偟偐偟丄側偐側偐婜懸偡傞傛偆偵偄偔姵幰偝傫偑彮側偄偺偱丄捠忢偼崱偍榖偟偟傑偟偨傛偆偵僗僥儘僀僪棧扙椕朄偺屻偵侾儢寧偔傜偄宱偭偰僀儞僞乕僼僃儘儞帯椕傪崌傢偣傞僐儞價僱乕僔儑儞帯椕偑堦斒揑偵偼峴傢傟偰偄傞偺偱偼側偄偐偲巚偄傑偡丅僀儞僞乕僼僃儘儞偺係廡娫偲偄偆帯椕婜娫傕曐尟偲傄偭偨傝崌偄傑偡偟丄僗僥儘僀僪傪巊偆偺傕曐尟忋栤戣偁傝傑偣傫丅僀儞僞乕僼僃儘儞帯椕偱傕俧俷俿丄俧俹俿偑崅偄丄偮傑傝俛宆娞墛僂傿儖僗偵懳偟偰柶塽墳摎偑偟偭偐傝婲偙偭偰偄傞恖偱側偄偲桳岠偱偼偁傝傑偣傫丅
僀儞僞乕僼僃儘儞帯椕偺応崌偼嵟弶偺係廡娫枅擔偟偭偐傝帯椕偟傑偡丅偦偆偟偰丄偦偺屻堐帩椕朄偲偟偰廡俀夞傑偨偼丄廡俁夞偱帯椕偟傑偡偑丄堦斒揑偵搳梌拞偵俧俷俿丄俧俹俿偑忋偑偭偰偙側偄偲側偐側偐帯椕岠壥偵寢傃偮偒傑偣傫丅嵟廔栚昗偼僂傿儖僗傪帩懕揑偵壓偘傞偙偲偱偡偑丄俛宆娞墛僂傿儖僗娭楢儅乕僇乕偵倕峈尨乮俫俛倕峈尨乯丄倕峈懱乮俫俛倕峈懱乯偑偁傝傑偡丅倕峈尨傪堿惈壔偟偰丄倕峈懱傪梲惈偵偡傞偲僂傿儖僗偑彮側偔側偭偰偔傞偺偱帯椕岠壥偺栚埨偵側傝傑偡丅僂傿儖僗偑帩懕揑偵彮側偔側偭偰偒傑偡偲丄娞墛偼杮奿揑偵椙偔側偭偰偒傑偡丅僀儞僞乕僼僃儘儞帯椕偼俧俷俿丄俧俹俿偑傓偟傠忋偑偭偰偔傞曽偑丄帯椕岠壥偑婜懸偱偒傑偡丅摿偵楢搳婜娫拞偺応崌偼俧俷俿丄俧俹俿偑傓偟傠忋偑偭偨曽偑椙偄傢偗偱偡丅偦傟偐傜廡俀夞偲偐廡俁夞偲偄偭偨娫寚帯椕偵擖偭偰偄傞偲偒偵傕丄傗偼傝娞墛傪婲偙偟偰偔傞偲岠棪傛偔僂傿儖僗偑壓偑偭偰偒傑偡丅偄偢傟偵偟偰傕僂傿儖僗偑壓偑傞傛偆側忦審丄偟偭偐傝椪彴岠壥偑忋偑傞忦審偲偟偰丄俧俷俿傗俧俹俿偑崅偄恖偺曽偑偑傛偄懳徾偵側傝傑偡丅娞憻慻怐偑埆偔丄偟偐傕俧俷俿丄俧俹俿偑係侽乣俆侽偺傛偆偵掅傔偺抣偑懕偔恖偺帯椕偼堦斒偵崲擄偱偡丅偦傟偐傜慻怐偼埆偔側偔偰傕僂傿儖僗偑旕忢偵懡偄偺偵丄俧俷俿丄俧俹俿偑寉搙偱偁傞偲偄偭偨傛偆側恖傕岠壥偑忋偑傝偵偔偄傕偺偱偡丅偁傞掱搙柶塽墳摎偑栚妎傔偨傛偆側恖偩偗偑椙偄寢壥傪偍偝傔傞偲偄偆偺偑崱傑偱偺幚忬偱偡丅
丂偦傟偵懳偟偰丄尰嵼偡偱偵岤惗徣偵怽惪偝傟偨儔儈僽僕儞偲偄偆栻偑偁傝傑偡丅偙傟偼媡揮幨峺慺慾奞嵻偱偡丅俛宆娞墛僂傿儖僗偑憹怋偡傞偲偒偵巊偆峺慺偱偁傞媡揮幨峺慺傪慾奞偡傞丄傑偨偼僂傿儖僗杮懱偱偁傞妀巁偺怢挿傪慾奞偡傞嶌梡傪帩偭偰偄傞栻嵻偱丄寣拞偺僂傿儖僗偑妋幚偵尭傝傑偡丅婛偵帯尡偑廔傢傝傑偟偰尰嵼岤惗徣偺怰嵏偑嵟廔抜奒偵弴挷偵棃偰偄傑偡丅偙傟偼俛宆娞墛偵懳偟偰偼侾侽侽mg傪侾擔挬侾夞暈梡偡傞宱岥栻偱偡丅暯惉侾俀擭偺弔偵偼怰嵏偑姰椆偄偨偟傑偟偰丄壞偔傜偄偐傜偼曐尟偱擣傔傜傟傞偺偱偼側偄偐偲偄偆尒捠偟偑尰嵼偁傝傑偡丅偙偺栻偺暃嶌梡偼慡偔偲尵偭偰椙偄傎偳偁傝傑偣傫丅寣拞偺俛宆娞墛僂傿儖僗偑偳傫側偵懡偔偰傕媫懍偵壓偑偭偰偒傑偡丅偡偽傜偟偄栻偱偡丅宱岥偱丄侾擔侾夞偱暃嶌梡偑側偄丅
偙傟傎偳栻偲偟偰椙偄忦審偵偐側偭偨峈僂傿儖僗栻偼崱傑偱側偐偭偨偲巚偄傑偡丅偟偐偟栤戣揰偼偁傝傑偡丅偙偺栻偵懳偡傞掞峈姅偺僂傿儖僗偺弌尰偑偁傞偲偄偆偙偲偱偡丅敿擭偐傜侾擭偲巊偭偰偒傑偡偲俁侽亾埵偵掞峈姅偑弌偰偔傞偙偲偑堦斣偺擄揰偱偡丅偦偺戙傢傝丄傕偟傕偦偆偄偆掞峈姅偑弌側偗傟偽敿擭丄侾擭丄俀擭丄俁擭偲暈梡傪懕偗偰傕傄偭偨傝偲僂傿儖僗傪梷偊偰偒傑偡丅僂傿儖僗偑尭彮偟偰偄傞娫偵倕峈尨偑堿惈壔偟傑偡偟丄倕峈懱傕偟偭偐傝偱偰偒傑偡丅傕偆堦偮丄偙偺栻偱僂傿儖僗偺堿惈壔偑懕偄偨傜丄偄偮巭傔偨傜傛偄偐偺栤戣偱偡丅栤戣偑側偗傟偽弴挷側宱夁偱傕悢擭娫偼暈梡偟傛偆偲偡傞峫偊曽偑偁傝傑偡丅彨棃偺栤戣揰偺傂偲偮偱偡丅崱傑偱偱偡偲僗僥儘僀僪棧扙椕朄丄偁傞偄偼僀儞僞乕僼僃儘儞丄偁傞偄偼偦傟傜傪慻傒崌傢偣傞偲偄偭偨帯椕朄偺傛偄懳徾幰偱側偐偭偨俛宆枬惈娞墛偺恖偵傕廫暘揔墳偑弌偰偔傞偩傠偆偲巚偄傑偡丅埲慜儔儈僽僕儞偺帯尡偵嶲壛偟偨偲偒偵丄巹偳傕偱傕俉儢寧娫偺暈梡偱帯偭偨恖偑偄傑偟偨丅倕峈尨堿惈偱倕峈懱偑弌偰丄僂傿儖僗傕應掕尷奅埲壓偵側傝帩懕偟傑偟偨丅
帯椕慜偺俧俷俿丄俧俹俿偑崅偄恖偱偟偨丅偁傞偄偼婛懚偺帯椕朄偱傕帯傞偐傕偟傟側偄傛偆側恖偑傗偼傝椙偔岠偄偨報徾傪帩偭偰偄傑偡丅俛宆枬惈娞墛偺応崌偼僂傿儖僗偑俠宆娞墛偺僂傿儖僗偵斾傋偰傕旕忢偵懡偔丄峈僂傿儖僗嵻偩偗偱擻棪椙偔攔彍偡傞偙偲偑側偐側偐傓偢偐偟偄偙偲傪堄枴偟偰偄傑偡丅柶塽墳摎傪忋庤偵巊偆偺偑帯椕偺僐僣偲尵偊傑偡丅柶塽墳摎傪嫮壔偡傞偙偲偼戝曄堄枴偑偁傝傑偡丅曐尟偱擣傔傜傟偰偄傞栻偱偼丄僙儘僔僆儞偲偄偆宱岥栻偑偁傝傑偡偑丄側偐側偐巚偭偨掱岠壥偑弌傑偣傫丅尰嵼帯尡偑峴傢傟偰偄傑偡柶塽晩妶嵻偺僒僀儌僔儞兛侾偲偄偆栻偑偁傝傑偡丅偙傟偼拲幩栻偱偡丅擬傕弌側偄偟丄杮摉偵暃嶌梡偼壗傕側偄栻偱偡丅巹偳傕偑巊偭偨報徾偱偼庒偄恖偺俧俷俿丄俧俹俿偑崅偄恖偵偼偐側傝桳岠偱偡丅倕峈尨傪堿惈壔偟偨傝丄倕峈懱偑弌偰偔傞偙偲傕宱尡偟偰偄傑偡丅慡崙揑側廤寁偑墦偐傜偢弌偰偔傞偲巚偄傑偡偑丄嵟廔揑側寢壥偼偳偆側傞偐暘偐傝傑偣傫偑丄庒偄姵幰偝傫偱偼桳朷側帯椕朄偵側傞壜擻惈偑偁傞偲巚偄傑偡丅偄偢傟偵偟偰傕俛宆娞墛偺応崌偼柶塽墳摎偑偟偭偐傝偟偰偄傞丄偮傑傝娞墛偑偟偭偐傝婲偙傜側偄偲偆傑偔偄偒傑偣傫丅