![]()
Multiple-Drug Resistant Enterococci: The Nature of the Problem and an Agenda for the Future
院内の菌血症、外科的な創傷の感染そして、尿路感染の原因を導く腸球菌は、全ての標準の治療に抵抗性を示すようになっている。新しく早いサーベイランスの方法は、その種のレベルにて、試験されている腸球菌の分離されているものの重要性を強調している。ほとんどの腸球菌の感染は、腸球菌の入った糞便が原因となって起こり、公然の病原性に関係のある特徴をあらわすのにより適当であり、また、少なくとも一つの有効な抗菌性に感受性を保持するのに適当である。そのままの感染は、主に、腸球菌の入った糞便が原因となって起こり、ある種では、知られている公然の病原性の特徴を、実質的に、欠いているが、最後の手段の抗生物質に抵抗性を持つのには、より適している。多剤耐性の腸球菌を有効に統制するには、1)腸球菌、病院環境、そしてヒトの間のよりよい理解
2)慎重な抗菌性の使用 3)病院と他の患者の看護環境のなかのよりよい接触の分離 4)向上したサーベイランスを要求するだろう。等しく重要なことは、付加的な薬剤の検索の中で、活力をよみがえらせられている事、新しい治療力のある実例の進化に伴って起こされた事である。
数年前には、増加していた重要性を腸球菌に目撃していた。最近まで、これらの腸共生生物は、誤って分類された連鎖球菌として見捨てられており、一般的に「重篤な感染の主な原因でなく心内膜炎の例外と髄膜炎のまれなケース」と認識していた。しかしながら、過去十年間の中で、腸球菌は、院内の菌血症、外科の創傷感染、そして尿路感染の原因を導くものとして認められるようになった。2タイプの腸球菌が、感染の原因となる。:1)それらは、患者の自然の植物相から生じており、その種の内因性を超えて抵抗性を所有する事はありえず、ベッドからベッドの伝播はありえないという事
2)複数の抗菌抵抗性の特徴を有し、院内伝達に有能であるものの分離である。多剤耐性腸球菌−それらの種は、二つもしくは、それ以上の抗生物質、よく含まれるがバンコマイシンは、制限されていない−の治療の試みは、sharper focus重要な院内のpathogensとしての役割をもたらした。抗菌抵抗性の増大と伝播は、腸球菌の間で、いくつかの臨床的分離は、すべての標準の治療に抵抗性があるという点において「抗生物質投与後の年代」の浮かび上がっている見込みと同様に現在の装備の脆弱性を目立たせている。このレビューは、一般的に腸球菌、そして特に MDR腸球菌によって持ち出された問題の大きさと性質に焦点が集まっている。多くの点で、代表的な言及のみが分けられている。
生息地と微生物学
腸球菌は、通常腸に住む。それらは、ゴキブリからヒトというほとんど全ての動物の腸内に見られる。腸球菌は、すぐに植生と表面の水から覆われる。おそらく動物の排泄物または、無処置の汚水による混入のためである。ヒトに、典型的に便の中への腸球菌の集中度は、180
CFU/gになる。口腔と膣路は、コロニーになることができるが、腸球菌は、これらの部位から20%よりすくなく除かれる。主な種類は、腸のvariesに住む。ヨーロッパ、合衆国等で、Enterococcus feacalisは、いくつかの例では、優位を占め、他では、E. fiaciumが優位を占める。長野コロニー形成を助長している生態学または微生物学的要因は、不明瞭である。14もしくは、それ以上の腸球菌の種類の中でE. faecalisとE. faeciumだけが、一般的にコロニーを形成し、検出可能な数値でヒトに感染する。E. faecalisは、人の感染の約80%から分離され、E. faeciumは、ほとんどの残りから分離される。他の腸球菌の種類の感染は、まれである。
腸球菌は、非常に頑丈である。それらは、
10から45の温度、低浸透圧性、高浸透圧性、酸性またはアルカリ性を含む広いさまざまな成長環境に耐用性を示す。アジ化ナトリウムと集められた胆汁塩は、ほとんどの微生物を抑制したり、殺したりするが腸球菌には許容的であり、寒天培地での選択の要因として使われる。任意の生物として、腸球菌は、減少され、酸素で処理された状況下で成長する。腸球菌は、普通、忠実な発行をさせるものとして考えられている。なぜなら、それらは、Kre’s cycleと呼吸鎖が欠乏しているからである。E. faecalisは、外来性ヘミンがb、dそしてo型のチトクロムを産生するのに使われているので例外である。134の腸球菌と関連のある連鎖球菌の調査の中で、E. faecalisとLuctococcus lactisのみがチトクロム様呼吸をあらわした。チトクロムは、好気性成長の間、E. faecalis成長を有利にさせる。E. faecalis チトクロムは、外来性ヘミンの存在する好気性状況下でのみあらわされ、さらに、不適正な部位のコロニー形成を促進する。
腸球菌は、内因的に多くの抗生物質に対して抵抗性をもつ。取得した抵抗性と病原性の特徴は、似ていない。たいていは、暗号化されたトランスポゾンかプラスミドであるが。内因性の抵抗性は、典型的に移せない染色体の遺伝子に基づく。ペニシリン、アンピシリン、ピペラシリン、イミペネム、とバンコマイシンは、一貫した抑制性を示すもっともすくない抗生物質であるが、
E. faecalisに対する活性と殺菌はない。E. faeciumは、E. faecalisより潺薀・織抗生物質に対する感受性が一層少ない。なぜなら、前者のペニシリン結合タンパクは、著名に抗生物質への類似性が低い。ペニシリンへの高い抵抗性をもつ株の最初のレポートは、1980年代に現れ始めた。
腸球菌は、しばしば、抵抗性(接合性トランスポゾン、フェロモン応答性プラスミド、そして他の広い宿主範囲をもつプラスミドに持ち込まれた暗号化している遺伝子)の交換を通して抗菌・抵抗性を獲得する。過去
20年は、MDR腸球菌の早い出現を目の当たりにした。高レベルゲンタマイシン抵抗性が、1979年に出現し、1980年代に院内感染の多数のレポートによりはやく理解された。同時に、院内のE.faecalisとE.faecium感染の散発性発生は、lactamase puroductionのためにペニシリン抵抗性で現れた。最終的に、バンコマイシンの感受性を失ったMDR腸球菌が、ヨーロッパと合衆国で報告された。バンコマイシン抵抗性腸球菌は、いくつかの表現形の中でVanA(バンコマイシンとタイコプラニンの抵抗性)とVanB(バンコマイシンのみの抵抗性)は、最も共通している。合衆国で,VanAとVanBは、それぞれ、バンコマイシン抵抗性腸球菌の約60%と40%を数える。これらの表現形を暗号化している誘導性遺伝子は,細胞壁合成を変化させ,グリコペプタイドに抵抗性の種を与える。
VanAとVanBの抵抗性は,第一に、臨床的、獣医学、食物試料から分離された腸球菌の中で見つけられ、他の共通の腸の、または、環境の細菌には,見られなかった。しかし、研究室では,これらの遺伝子は,腸球菌によって運ばれる。例えば,黄色ブドウ球菌は,膜フィルターの表面と無毛の肥満のマウス上のE.faecalisからの明らかな抵抗性の伝達を通してバンコマイシン抵抗性を与えられ、バンコマイシン抵抗性S.aureusの出現に生物的バリアーはないことを示す。バンコマイシンへの感受性を減らした種は現れたが高度にバンコマイシン抵抗性を持つS.aureusの臨床的分離はまだ特定されていない。これらの種の抵抗性の機構は無決定であるが、VanAとVanBの表現型を結びつける遺伝子を伴っているように見えないのである。
疫学
腸球菌は毎年合衆国で
1100000件の尿路感染と25000件の菌血症と40000件の創傷感染と1100件の心内膜炎を引き起こす。病院で最も多く感染が発生する。いくつかの研究では近年腸球菌の院内感染の割合の増加を暗示しているが、国家の院内感染のサーベイランスシステムデータは過去20年以上腸球菌の血流(12%VS7%)外科的部位(15%VS11%)尿路感染(14%VS14%)という率で変化がほとんど無い事を示している。1980年より前の適当なサーベイランスデータは利用出来ない。腸球菌の感染脂は確認が困難である。なぜなら、厳しいcomorbit illnessは共通のものであるからである。しかし、腸球菌の敗血症は致死的なケースの7〜50%に関与する。いくつかのケースコントロールと歴史的同齢集団の研究は感受性のある腸球菌の菌血症に関連する死の危険より抗菌抵抗性の腸球菌の菌血症の死の危険の方が数倍高い。MDR分離種がもっと流行するとこの傾向は増加しそうである。
MDR
腸球菌のコロニー形成と感染は世界的に発生する。初期のレポートでは合衆国内ではVREによる院内感染の率が1989年から1993年の間に20倍(0.3〜7.9%)に増加したことを示している。サーベイランスネットワーク(TSN)データベース(USA)のように新しいデータベーステクノロジーは今日種類による抵抗性プロフィールの評価を認可している。TSNデータベースが100以上の合衆国の臨床研究室の日々のデータを収集し編集している。そして誤りをテストしている研究室を確認し抵抗性プロフィールと公衆衛生の脅威を提起するメカニズムを見つける。(例えば、バンコマイシン抵抗性ブドウ球菌)
1995
年と1997年9月1日の間のTSNデータベースによって集められたデータはバンコマイシン抵抗性の初期の増加はバンコマイシンに独特のものだったか、それは継続する傾向にあるか、種分化は分析しているこの抵抗の中で重要なことかどうかを決定するために分析されていた。バンコマイシンとアンピシリンの抵抗性E.faecalisはまれである。1995年から1997年に起こった抵抗性の有病率はほとんど変化がない。対照的にE.faeciumのバンコマイシンとアンピシリン抵抗性は驚かされる程増加した。1997年E.faeciumの分離の1482のうちの771(52%)はバンコマイシン抵抗性を示し、1474のうちの1220(83%)はアンピシリン抵抗性を示した。(図1)E.faeciumは、抵抗性であるにもかかわらず、E.faecalisが、TSNデータベースの中で二つの腸球菌の種類のうちで一般的にだんぜん多く出くわす。E.faecalisとE.faeciumのトータル分離は、約4:1で、血液3:1、尿5:1であった。(図1)この知見は,生存策と治療力のある成功の尤度の中での重要な違いを強調しており、批判的な因子は,たいてい腸球菌の種類または腸球菌としていっしょに生物を一様に扱うことであいまいにしていた。E.faecalisのなかのアンピシリンとバンコマシン抵抗性の広範囲の出現と播種は、最近の治療力のある窮地を有意に打ち破るだろう。バンコマイシンとアンピシリンの抵抗性は,E.faecalisでなくE.faeciumの種類に選択的に有利に供給することは,疑う理由がほとんどない。
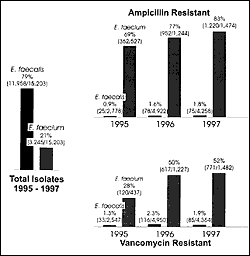
Figure 1. Epidemiology of enterococcal infection based on 15,203 susceptibility results obtained by The Surveillance Network (TSN) Database-USA, 1995 to Sep 1, 1997. The increase in total numbers between 1995 and 1996 represents additional reporting centers coming on line. Numbers for 1997 represent total collected for the partial year to Sep 1, 1997.
E.faecalis
にこれらの抵抗性の相対的非存在は、特徴の浸透度と平衡のつかの間の欠乏を簡単に反映するかもしれない。二つの種類のこれらの重要な違いのために、腸球菌の抵抗性の重要なサーベイランスは,種類の同定を含まなければならない。
MDR
腸球菌の院内の伝達の正確な様式が、証明することが困難なので,分子の微生物学と疫学的証拠は,患者間、ヘルスケアプロバイダーの手と医療器具、そして、延長された腸のコロニー形成をもつ患者による病院間の伝播を堅固に示唆している。 MDR腸球菌のすくなくとも16発生は,1989以来報告されていた。二つのほとんどが,E.faeciumのためだった。この不同は、特に臨床的E.faecalis分離のより高い数の見解のなかで、E.faeciumに発生する抵抗性のコンビネーションの目新しさのためにレポートしているバイアスを反映するかもしれない。
MDR
腸球菌の発生からの分離が、遺伝的顕著な特徴により分析されたとき、半分以上が,関係のある分離を伴う。
前の抗生物質の処置は,
MDR腸球菌にコロニー形成されたまたは感染した患者のほとんど全てが共通のことである。クリンダマイシン,セファロスポリン、アズトレオナム、シプロフロキサシン、アミノ配糖体、そして、メトロニダゾールの使用は,バンコマイシンの使用と等しく,または、それ以上にMDR腸球菌のコロニー形成または感染と関連付けられる。
感染統制
患者の間の
MDR腸球菌の伝播を制御することが困難である。腸球菌の伝達の生物学または外来性の腸球菌によるコロニー形成を支持する特異的微生物の因子について相対的にほとんどないことを私たちは,知っている。にもかかわらず、VRE感染は,政策を支配すし、それは,MDR腸球菌に適用することが出来、the Hospital infection Control Practices Advisory Committeeにより発表された。統制方法には臨床的分離の中でバンコマイシン抵抗性の日常的スクリーニング、示強性看護中のVREの活動的サーベイランス、人から人への伝達を最小化するための接触の単離、そしてバンコマイシンの制限を含む。
VRE
伝播の限界に対してこれらの政策は時々失敗した。全ての病院が活動的なサーベイランスを成し遂げることが出来たわけでもなく、進んでやったわけではない。なぜならより多くの患者が典型的に感染よりもVRE(3%〜47%)でコロニー形成されているからで、腸のコロニー形成は延長されうるし、日常文化によって受動的サーベイランスはコロニー形成された患者を未同定のままにし、そして続いたVREの伝播のポイントソースとして対応しうる。全てのコロニー形成されている患者が首尾よく特定されたとしてもVREは不適切な手の洗浄またはベッドレール、シンク,蛇口、ドアノブのようなものの接触を通してヘルスケアワーカーにより広がるかもしれない。(腸球菌は環境で数週間生き続けることが出来る。)汚染除去の努力が厳正な施行であるに違いない。
the Hospital infection Control Practices Advisory Committee
はかたくなにVREを統制するために経口または非経口のバンコマイシンの制限を勧めた。しかし、他の広域性抗生物質の広範囲の使用を無視してもバンコマイシンの制限使用がVREとMDR腸球菌の最大の統制とはなりそうではない。
抗生物質は少なくとも
2つのメカニズムによって、MDR腸球菌のコロニー形成と感染を促進する。第一に広域性抗生物質は抗腸球菌活性をほとんどまたはまったく持たない。そして投与は一般的に感染で危険な部位で感受性(または抵抗性)腸球菌の過成長に導く。第二にほとんどの抗生物質は外来性生物によるコロニー形成に対する腸管の正常な抵抗性を実質的に減少する。コロニー形成抵抗性は第一に成長の嫌気的植物相の制限性作用から生じ、そして無傷の粘膜、胃酸分泌、腸運動、腸関連免疫から、劣る範囲に生じる。腸の保護性植物相の中の抗菌性誘因改変は、MDR腸球菌のような外来性pathogensのコロニー形成の大きな足がかりを供給する。もし、抗菌制限プログラムが,全ての抗生物質の慎重な処方を含み、バンコマイシンのようなものに対し選ばないようなものならば,それらは,より有効になるだろう。このアプローチは、バンコマイシン、セフォタキシム、そしてクリンダマイシンを制限したある病院の薬局のなかでVREの腸のコロニー形成を実質的に減少させた。
最小で,MDR腸球菌の統制のための成功したプログラムは、コロニー形成され、感染した患者を同定するために有効な受動的そして活動的なサーベイランス、ヘルスケアワーカーによる単離に接触するための絶対的粘着、患者接触区域の徹底した汚染除去、そしてバンコマイシンと他の広域性抗生物質の賢明な使用または制限が必要なのである。
治療法の研究
好中球が減少している状態での多剤耐性(
MDR)腸球菌の感染症、例えば心内膜炎や菌血症を治療するために、適した抗生物質が常に利用できるというわけではない。とりわけペニシリンとバンコマイシンの併用や、シプロフロキサシンとアンピシリンの併用、ノボビオシンとドキシサイクリンの併用が使われてきたが、(効果は)予測できず、臨床的には証明されていないままである。ある報告書では、クロラムフェニコールがクロラムフェニコール感受性感染症をうまく治療できたとあったが、これらの成果は制御実験での確認待ちである。
研究中の効果の期待できる
MDR腸球菌感染に対する抗生物質には、フルオロキノロン、ストレプトグラミン、オキサゾライディノン、半合成糖タンパク、グリシルサイクリンがある。シプロフロキサシンに匹敵するほど腸球菌に対する作用強度を高めたフルオロキノロンであるクライナフロキサシンはVREに対してすばらしい活性を持ち、試験管内で殺菌性をあらわし、マウスモデルでの腸球菌感染症の治療に有効性を示した。クライナフロキサシンへの一段階ごとの耐性は試験管内では発見できなかったが、多段階の耐性は容易に達成された。もしこの薬剤が腸球菌感染症の治療への使用を認められたら、耐性(の段階)に合わせて選択することによって、薬剤の効果が制限されるかもしれない。
クイヌプリスティン/ダルフォプリスティン(シナーサイド)は蛋白質合成を阻害するストレプトグラミン
A とBを組み合わせたものでクライナフロキサシンよりも腸球菌に対する活性がより狭い。全てではないが、多くの表現型VanAとVanBをもつE.faeciumの分離株は感受性が高い。しかしながら、E.faecalisは一様に耐性をもち、重感染が治療の間に報告された。それに加えて、クイヌプリスティン/ダルフォプリスティンは静菌性しかなく、潜在的には耐性が出現する余地がある。これらの理由から、その薬剤にはMDR腸球菌感染症の治療において限られた役割しかないかもしれない。新しい種類のオキサゾライディノンとグリシルサイクリンもまたMDR腸球菌を含む腸球菌に対して強力な活性を示したが、さらなる研究が待たれる。
広範囲にわたる研究の実質的な欠点は、多くの有機体(病原菌はもちろん保護性共生動物も)が影響を受ければ受けるほど、ますます進化した耐性獲得の可能性が多くなることである。広範囲にわたる抗生物質によって、特別な診断もなく経験的に治療することが認められ、短時間での投資でより実質的な報酬が生み出された。しかしながら、広範囲にわたる抗生物質は、疾病を引き起こす有機体だけでなく、耐性さもなければ珍しい変異や遺伝子交換の結果を生み出すほど大量の共生動物にも影響を与える。市場の勢力が広範囲の薬物療法学を支持する限り、耐性を出現させる薬物導入の悪循環は間違いなく続くだろう。
目標とする薬物療法学
広範囲にわたる抗生物質治療に依存してきた歴史とは対照的に、迅速な診断技術を継続的に発展させたり導入することで、感染症治療のより集中的な研究が可能になるかもしれない。宿主反応を破壊させたり、感染中に組織を傷つけたりといった無数の微生物―宿主間の相互作用はどんなものでも強力な治療目標が示されている。しかしながら、疾病発生の病理における多くの重要な相互作用はこれらの相互作用の特異性のため、迅速で正確な診断が求められる。しかしながら、宿主と特異的病原体の間の相互作用にのみに的を置いた薬物療法学では、多様に共生している植物相に絶対に影響を与えないままにしてしまうだろう。結果として、標的となる集団は比較的少数の疾病を生み出す細菌へと限定され、おそらく耐性を生み出すのに必要な数や多様性を統計学的確率に到達させることはないだろう。
新たな抗感染症の化合物の同定への最近の研究範囲には2つの最終的手段がある。1)偶然微生物の性質を阻害する物質を同定するために膨大な化合物の情報をふるいわける。2)宿主組織の損傷や弱体化を引き起こす決定的な出来事を同定するために宿主と寄生虫の間の相互作用を詳細に研究する。
現在の治療法の最も適した使用法はもちろん新しい治療法の研究に対する長期的な観点で考えて、私たちや他の人たちは腸球菌と宿主の間の相互作用を細かく調べ始めた。主な障害は腸球菌もまた共生生物や自生種植物相の一部を形成しているということである。例えば、腸球菌は系統的にあからさまな病原体に関与している性質をほとんど持っておらず、宿主には潜在的な相互作用しか持たない。わずか
10個の有機体で接種材料を使うことで、私たちは宿主―寄生虫間の相互作用を調べるための感受性の高い生物学的機構を発達させた。
E.faecium
菌株はE.faecalis菌株よりも非常にしばしばバンコマイシンやアンピシリンに耐性をもつが、これらの種によって引き起こされる感染症の比較的な比率は、近年ではあまり劇的に変化していない。(図1)2つの菌は両方とも頻繁に共生植物相から分離されるので、この傾向からE.faecalisの性質の方がより大きな程度の内因性の病原性、例えば、細胞溶解素の生産、フェロモン応答性プラスミドの伝達(凝集物質の生産を伴う)、細胞外スーパーオキシドの生産、一時的にEspと呼ばれている新しく同定された表面蛋白質、を与えているということが示唆される。(図2)これらの性質は、新たな目標となる、腸球菌性疾病の治療法の研究を生み出すことに、論理的な出発点を与えている。E.faeciumと宿主の間のもっと微妙な相互作用の検査法は、腸球菌の生物学の理解が発展したときに結果として生み出されるだろう。
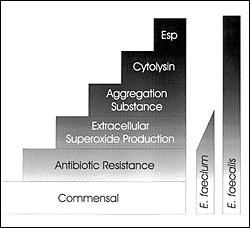
Figure 2. Virulence traits and their association with enterococcal species.
E
.faecalisの細胞溶解素に向けて
細胞溶解素は疾病に関連しているE
.faecalis菌株によって不均衡に絞り出される。この細胞溶解素は、ある種の血液寒天上で溶血帯として観察される活動によって、細菌細胞や赤血球、ほかの哺乳類の細胞を含む様々な標的細胞膜を破裂させる。細胞溶解素は有毒性やいくつかの感染モデルでの感染におる死亡率を与え、院内菌血症による突然死を5倍も増加させる危険と関連している。細胞溶解素はまたマウスの菌血症モデル(図3)で腸球菌が出現したことの一因にもなっており、ある観察ではヒトの血液分離のなかでの細胞溶解性菌株が不均等に出現したということと一致している。
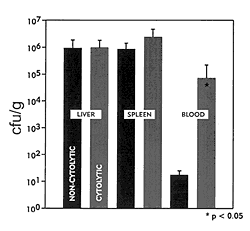
Figure 3. Cytolysin favors the appearance of circulating enterococci. In this experiment, 107 CFU of E. faecalis, either cytolytic FA2-2(pAM714) (60) or noncytolytic FA2-2(pAM771) (64), were intraperitoneally injected (45) into groups of five BalbC mice. Viable bacteria in liver, spleen, and the bloodstream were enumerated 48 hrs following injection, and significance assessed by Student's t-test. (P. Coburn, L.E. Hancock, and M.S. Gilmore, in preparation).
1934
年にE.W.Toddで始まり、ついに細菌の研究になったが、E.faecalisの細胞溶解素は今や広範囲に修飾可能な細菌毒素である、唯一のものとして特徴づけられた。(図4)細胞溶解素が成熟する経路は、理想的には治療目的のために構造解析される。なぜなら、2つの構造サブユニットが細胞外蛋白質分解酵素によって活性化され、結果として新たな治療法として使用でき、潜在的に阻害剤となり得る。その上、活性因子蛋白分解酵素である、CylAはセリンプロテアーゼのサブチリシンクラスに属しており、その構造と機能の関係と阻害剤の構造を私たちは理解し始めているところである。調査は、腸球菌が広まっているレベルで実験記録に基づく減少が、細胞溶解素の変種の行動が観察されることから予想できたときに獲得できるかどうかを決定するために、細胞外細胞溶解酵素の活性を阻害する物質を考え出したり、検査している最中である。(図3)
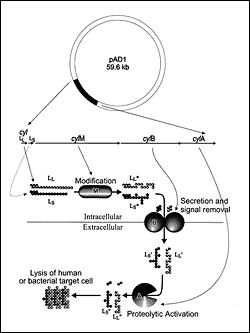
Figure 4. Cytolysin is expressed and processed through a complex maturation pathway (64). The cytolysin precursors, CylLL and CylLS, are ribosomally synthesized. The putative modification protein, CylM, is required for the expression of CylLL and CylLS in an activatable form, and the secreted forms, CylLL and CylLS were recently shown to possess the amino acid lanthionine as the result of posttranslational modification (64). CylLL and CylLS both are secreted by CylB (65), which is accompanied by an initial proteolytic trimming event (64) converting each to CylLL' and CylLS', respectively. Once secreted, CylLL' and CylLS' are both functionally inactive until six amino acids are removed from each amino terminus. This final step in maturation is catalyzed by CylA (64), a subtilisin-type serine protease. Since this final catalytic event is essential, occurs extracellularly, and is catalyzed by a class of enzyme for which a substantial body of structural information exists, it represents an ideal therapeutic target. As shown in Figure 3, inhibition of cytolysin by mutation (or potentially by therapeutic intervention) results in a reduction by several orders of magnitude in the number of circulating organisms.
細胞溶解素の活性化の阻害剤には、適切なすばやい診断学とあいまって、E
.faecalisの細胞溶解菌株が、共生植物相に影響を与えずに引き起こす菌血症を治療する際に、潜在的な価値をもつにちがいない。標的となる細菌が少数であることと、抗生物質と違って、細胞溶解素阻害剤は直接生物そのものに作用するわけではないという理由から、耐性が生まれるということは起こりそうもない。
他の腸球菌の標的
いくつかの研究所ではE
.faecalisのゲノムや他の病原体ゲノムの情報を使って、治療力のある標的を同定したり、非細胞溶解性腸球菌の感染症の残り60%に対する病理発生について研究を促進させたりしている。複数の院内感染を」引き起こしたE.faecalis菌株のゲノムは配列分析によって高頻度に採取された。いくつかの配列には、宿主―寄生虫間の相互作用の役割があるようだ。Espを特定する遺伝子は、異常な反復構造をもつ見せかけの表面蛋白質をコードする。腸球菌感染症でのこの蛋白質に対する役割はいまだに決定されていないが、臨床的な共生株間のその分布が明らかにされることが待ち遠しい。この遺伝子をもつ30菌株のうち29株が菌血症や心内膜炎にかかっている患者から回収された。34分離株のうち1株はEspをもつ健康なボランティアの人から採取された。この大きな蛋白質(推定202kDaの大きさ)の中心部は高度に保持された直列型246塩基対の反復によってコードされた82個の一連のアミノ酸の反復からなる。一連の反復で分岐が不足すると、おそらく感染中に組み替えが高頻度に起こると思われる。その上、さまざまなE.faecalis分離株の相同遺伝子で観察された反復数は3〜9回である。この遺伝子の側面には、IS905のトランスポザーゼに似た配列が置かれている。24の臨床的または実験室でのE.faecium分離株のいずれもこの遺伝子を持っていなかった。
次に見込みのある先端の研究は一連の遺伝子がグラム陰性菌の酸素抗原合成に関わる酵素に非常に関係のある産物をコードしているということである。予備的証拠によってE
.faecalisのこれらの遺伝子は細胞壁の糖合成に寄与しているということと、この糖(炭水化物)は生体内での存続に関与しているということが示されている。これらの遺伝子の1つをノックアウトして試験管内で成長させると正常な菌株となるが、皮下注射した後では変異体が、親の野生型株よりももっと簡単に取り除かれた。研究されたその遺伝子のうち1つは、実験されたE.faecalis菌株の全てに存在していたが、一方、別のものは過ヨウ素酸感受性抗原決定基を持つE.faecalisのみに存在する。総体的にいうと、これらのデータはE.faecalisの膜表面の糖を合成するための酵素は、生体内で存続するために重要であり、役立つ治療法の標的となるかもしれない。異なる研究を取り上げるとすると、Arduino et al.が、E.faecalisではなくE.faecium菌株のいくつかに結合している蛋白質分解酵素に耐性の過ヨウ素酸感受性物質を同定した。それは試験管内で食作用に対する耐性を与える。上述した研究中のE.faecalisの推定上の糖とE.faeciumの阻害物質との間の関連性は、これから決定されなければならない。多くの腸球菌は、生体内で生物学的に重要なレベルでそのような糖を産生するが、E.faeciumのいくつかの菌株は試験管内でそのような糖を産生する。
最後に、最近の観察から、ほとんどすべてのE
.faecalis菌株と少数のE.faecium菌株のみが実質的な細胞買いスーパーオキシドを産生するということが示されている。心内膜炎と菌血症にかかっている患者から分離されたE.faecalis菌株と健康なボランティアの人から分離した菌株と比較すると平均して細胞外スーパーオキシドの生産は、共生菌株より血液分離のなかで60%も高かった。これらのデータはいくつかの疑問を生じた。より大量の細胞外スーパーオキシドを産生するE.faecalisはより代謝性柔軟さと持って腸以外の感染部位への適応を容易にするのではないか?遊離基産物は宿主細胞の損傷を引き起こし、シトクロム形成を通してE.faecalisの成長を高めようと促すかもしれない、正常では隔離されている栄養物(例えばヘミン)を遊離させることを可能にするのか?抗オキシダントはコロニー形成や浸潤性感染を変調したりするだろうか?これらの疑問に対する答えは、腸のコロニー形成から感染までの遷移へ新たな洞察を与えたり、新たな予防薬の計画を示唆するかもしれない。
さらなる発展への障害
腸球菌の生物学と病理発生への重大な洞察は、逆に遺伝的研究から収集されているところだが、どうやって腸球菌は腸管に寄生して感染症の原因となるのかという点において、まだ情報が不足している。例えばE
.faecalisやE.faeciumはヒトの上皮細胞や腸のムチンのリガンドと特異的に相互作用することで大腸に寄生しているのだろうか?MDR腸球菌は、常在性腸球菌と競合せずに新たな腸管部位に寄生できるようにする、交代性の結合活性を持つのだろうか?促生物質は、コロニー形成耐性を、広域性抗生物質によって変えられた腸の生態系に戻す役割を持っているのか?
高度耐性院内病原体の出現と闘うために十分なことがなされているか?効率的に競合するために、産業は市場の機会に非常に敏感になった状態にある。公共部門の研究は反応するのに緩徐であった。そして結果として、私たちの腸球菌感染の生物学への理解は不十分となっている。公共部門の応答が控え目である理由には次のようなものがある。1)感染症研究と関連して、非エイズを支持する民衆が減少したのと同時に耐性腸球菌の出現が起こった。2)院内感染の病理発生は、義務づけられた病原体に対して、確立された範例から外れている。3)伝統的にヒトの疾病の病因物質としての町球菌は、重要性が低く、
1980年代になって抗生物質耐性の研究が深まったため、研究基盤が比較的小さい。
結論
歴史的には、実質的な手段が、モデル生物体の分子生物学を徹底的に理解するまで発達した時に発見されていた。
1960年代と1970年代の間、グラム陰性菌が院内感染や集団感染の原因を引き起こし、グラム陽性菌に現存する抗生物質への感受性が典型的にはあった時に、グラム陰性菌モデルの作成に相当な投資をしたのは適切ではあった。しかしながら、1990年代にグラム陽性菌が院内感染と集団感染の両方の原因を導くものとして出現すると、公共の研究の優先すべきものとして再評価が保証された。抗生物質の使用が
50年前に世の中に広まって以来、細菌は刻々と日常的に耐性を発達させてきた。耐性の出現を制御するには、病院や診療所で慎重に抗生物質を使用することへ新たに取り掛かることによってなされるであろう。また、ある部分ではMDR腸球菌への監督を改善することと、医療スタッフに保菌容疑者を隔離する手順に執着するよう促す、より良い体制に基づいている、知られていて潜在的に新しい標的をねらった、より狭い活性をもつ薬を開発することと、市場がその使用を支持するような状態に発展させることが同じくらい重要である。上述した研究のある部分は、退役軍人援護局、民間健康サービス(
EY08289とAI41108)からの研究奨励金、失明防止研究からの奨励金によって支持されてきた。Dr
.Hurckeは、オクラホマ大学健康科学センターの医学研究部門感染症分野の準教授である。彼はE.faecalisが細胞外スーパーオキシドの生産をしているという点で腸球菌の病理発生に興味を持っている。