![]()
Diversity among Multidrug-Resistant Enterococci
腸球菌は、地域社会と伝染病に侵された病院との両方と関係がある。
腸球菌が感染性ショックのような苛酷な全身性の炎症性反応を引き起こさないにしても、腸球菌は、全ての商業的に入手可能なアミノ配糖体系抗生物質であるペニシリン、アンピシリン、バンコマイシンなどの細胞壁に活動的な動因を持つ抗菌性薬の抵抗性への膨大な配列を持つため、治療の課題を提示している。
アンピシリンとバンコマイシンの組み合わせは、他の多くの抗菌性薬への抵抗性の一種として不相応に起こったものである。
腸球菌が抵抗性を獲得しようとする性向は、多様な抱合形態へ関与しようとする腸球菌の能力に関連するかもしれない。その結果、接合性トランスポゾン、フェロモン−応答性プラスミド、または広い宿主範囲プラスミドの部分的遺伝子伝播が可能になる。
腸球菌の耐久力はおそらく、多剤耐性クローンの環境における生存増進によって抵抗性を得、人から人への強力な伝播性が増進するのである。
腸球菌は、今世紀までに感染性の心内膜炎なために知られていたが、最近では院内感染や抗菌性を受ける患者の重感染として認識されるようになった。
腸球菌は院内感染の多くを説明するのに、複数の抗菌性薬に対する抵抗性のため、注意しなければならないことが増えつつある。
院内感染と最も関係のある腸球菌は尿路、外科的創傷による流出、また菌血症による感染がある。
腸球菌はおもに腹腔内または骨盤感染にて現れる。すべての患者がこのような特異的抗腸球菌治療を必要とした感染ではない。
他の腸球菌の感染は(骨膜炎や菌血症を含む)病気の新生児の感染や、中枢神経系の外科手術、またはくも膜下腔内の化学療法の歴史とともに、大人の中枢神経系の感染などがあり、またまれに骨髄炎や肺の感染も見られる。
腸球菌は、感染の原因となる肝臓移植患者の肝臓または胆汁をTチューブに留置してコロニー形成により頻繁に起こる。
抗菌性
抵抗性ほとんどの腸球菌は自然発生するか、セファロスポリン、半合成ペニシリナーゼ抵抗性ペニシリン系抗生物質(例えばオキサシリン)、臨床的に達したクリンダマイシンの集合物やアミノ配糖体系抗生物質といった多様な薬物に対する固有な抵抗性を持つ。
連鎖球菌と比較するとほとんどの腸球菌はペニシリン、ウレドペニシリンといったものに相対的に抵抗性を示し、MICsでE.
Feacalisは1窮/ml,から8窮/mlで、E.feaciumでは更に高い。多くの腸球菌はアンピリシンやバンコマイシンを含む細胞壁に活発に働きかける殺傷要素にも寛容で、最近のデータではこの性質は固有のものでなく、むしろ抗生物質が出てきた後に得た性質であることを示唆している。
生体内でのトリメトプリムスルファメトキサゾールへのE.
Feacalisの固有な抵抗性は動物モデルでは効力の欠乏と説明されている。試験管内ではトリメトプリムスルファメトキサゾールは低濃度で多くの腸球菌に容易に入るが、この活性は外来性葉酸によって弱められる。
更に、E.
Feacalisに対する殺菌活性は確実でなく、とても依存的な方法のように見られる。動物モデルではこの組み合わせは有効な活性がみられず、一般に効率的な抗腸球菌治療、特に全身性感染に対しては受け入れらてれない。
多くの動因に対する自然抵抗に加えてさらに、腸球菌はテトラサイクリン(ミノサイクリン、ドキシサイクリンなど)、エリスロマイシン(アジスロマイシンとクラリスロマイシンの合成物)、クロラムフェニコール、高レベルのトリメトプリム、そして高レベルのクリンダマイシンへの抵抗性を達成させるプラスミドやトランスポゾンも発達させてきた。
E.
Feacalisが複数抗菌性抵抗性の特質を得ようとする性向の結果、明瞭に異なる種々の抱合機能、すなはち細菌性接合がみられるようになったのだろう。最も良いのはフェロモンやフェロモン応答性プラスミドといわれるオリゴ糖を含む抱合システムを研究することである。
要するに、
E.Feacalisの品種は、培地に異なるプラスミドに特異的な多くの異なる小さなペプチド性フェロモンを典型的に分泌する。フェロモン応答性プラスミド(強力なドナー細胞)を含む細胞が相当するフェロモンと接触したとき、プラスミドの遺伝子転写はその表面にある粘着性物質(凝集物質と言われる)の合成に起因する。
ドナー細胞が他のE.
Feacalisにぶつかったとき、2つのアルギニンーグリシンーアスパラギン酸モチーフを含む凝集物質は多くのE.Feacalis細胞の表面の結合物質に、凝集塊をつくろうとしてくっつく。試験管では、目で見れるほどに凝集した細胞の塊が実際に管の底に沈着する。
プロセスはまだ良くわかっていないが、フェロモン応答性プラスミドはドナー細菌から他の(受取人)細菌へと伝達可能である。
一度受取人細胞がこの特定のプラスミドを受け入れると調和性フェロモンの合成が自己を塊にするのを防ぐ妨げとなる。
E.
Feacalisで第一に起こるこの抱合システムは高性能で、結果としてフィルタとブロスにおけるプラスミドの伝達となる。その他の抱合システムもよくわかっていないが、腸球菌の種や連鎖球菌に由来する他のグラム陽性やブドウ球菌で伝達できる広い宿主範囲プラスミドを含んでいる。
伝達頻度は一般にフェロモンシステムよりもかなり低く、ブロスよりもフィルタのほうがより効率的である。
ブドウ球菌、連鎖球菌そして腸球菌が多くの抵抗性遺伝子を占めているので、これらの広い宿主範囲プラスミドは、これらの抵抗性遺伝子を異なる属に伝播する機構となる。
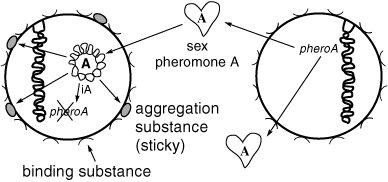
Figure 1. Enterococcus faecalis pheromone-responsive conjugative system.
Pheromone A released from the potential recipient cell (right) interacts with plasmid A in the potential donor cell (left) to induce synthesis of aggregation substance. Attachment of aggregation substance to binding substance causes the cells to clump into visible aggregates. Once the pheromone-responsive plasmid A has transferred from donor to recipient cell, synthesis of pheromone A is shut off.
一度、フェロモン応答性プラスミドAがドナー細胞から受取人細胞へ伝達されると、フェロモンAの合成は行われなくなる。
トランスポゾンを含む第三の抱合型もまた異なる種への抵抗性遺伝子の伝播で説明される。
1つの細胞の中で、あるDNAの位置から他のDNAの位置まで飛ばすことのできる通常のトランスポゾンとは反対に、接合性トランスポゾンは異なる細菌性細胞間で抱合を引き起こす能力をコードする。
プラスミドは典型的に複製(たいていが宿主タンパクとの相互作用に成功することに依存している)のための複合体機構を必要とし、表面の排除や不適合性といった表面の付加的問題も必要となるが、接合性トランスポゾン(複製していないが、新しい宿主の染色体かプラスミドの中に挿入されている)はより効率的で抵抗性遺伝子を広く普及させる手段のように見られる。
これはなぜ接合性トランスポゾンTn916のtmtM遺伝子がグラム陽性菌種よりもマイコプラズマのような淋菌、髄膜炎菌、軟性下疳菌を含むグラム陰性菌源に伝播性があるのかを説明できるかもしれない。T
エリスロマイシンやカナマイシンに対する抵抗性を暗号化した遺伝子を組み込んだ、他の抵抗性遺伝子もまた、
Tn916を頻繁に含む、又はこれと関係のある接合性トランスポゾン上で発見される。これらのトランスポゾンは
Tn916の祖先から進化したのであろう。というのは、これらのトランスポゾンの出現はグラム陽性菌源においてもっと前の抵抗性播種の可能性を提示しているからである。特に、機能において、接合性トランスポゾンと同様に現れる大きな接合性染色体要素での
vanB遺伝子集団の調査が前兆となった。
高レベルアミノ配糖体抵抗性
抵抗性を取り込んだ動因が一般的に、腸球菌の治療、(例として、アミノグリコサイドに対する高レベル抵抗性(
HLR)があげられる)に非常に影響を及ぼす他の抵抗性として使用されない為に、遺伝子が腸球菌の抵抗性を得ることは臨床的に重要なことではない。この抵抗性は、正常なアミノグリコサイドに対する腸球菌の低レベル抵抗性がさらに増したことと、典型的に
MICsが>2000窮/mlという結果を出している。例外を除いて、抵抗性のこの度合いは、細胞壁に働く動因と、生物体が高度に抵抗性を示すアミノ配糖体との相乗作用の抵抗性を予見している。
高レベルアミノ配糖体への抵抗性は、、酵素修飾のアミノ配糖体にもっとも多くある。ストレプトマイシンへの
HLRもまた、リボソーム抵抗性をストレプトマイシン抑制へと変異させる。ゲンタマイシンを除くカナマイシンへの
HLRはかなり共通の形質を持ち、3’リン酸転移酵 素、APH(3’)-lllを産生するのに十分である。この酵素は重要である。というのは、この酵素の
HLRが必然的にアミカシン与えるわけではないけれども、細胞壁に働く動因とアミカシン(3’ヒドロキシル基のリン酸化ではあるが)との相互作用を排除するからである。ゲンダマイシンへの
HLRは、一つの6’アセチル基転移酵素活性と、もう一つの2”リン酸転移酵素活性といった二つの活性を持つ一つの遺伝子から読み取った二機能性タンパク質(AAC(6’)-1/APH(2”)-1)から起こる。これらの活性の組み合わせによって、
HLRまたは、この酵素によって修飾されないストレプトマイシンを除いた全ての商業的に入手可能なアミノグリコサイドにとっての相乗作用の抵抗性といったものが起こる。しかしながら、ストレプトマイシンへの
HLR(リボソームの抵抗性かストレプトマイシンのアデニル酸転移酵素のどちらかによる)もまた他のアミノグリコサイドのHLR遺伝子と共通しており、共存できる。スペクチノマイシンもまた二機能性酵素で修飾できないが、真のアミノ配糖体でないこの薬剤は一般に、腸球菌に対して殺菌作用がなく、また細胞壁に働く動因への相乗作用も見られない。
併用療法を望む、心内膜炎や他の重篤な伝染病の患者から採取した腸球菌の緊張は、ストレプトマイシンやゲンタマイシンのHLRにスクリーニングすべきである。
トブラマイシンは一般に成し遂げられないし、原理において
E.feacalisに用いられるのが得策でも、遊離したE.faeciumが染色体性に読みこまれて、トブラマイシンとの相乗作用、それはHLRを起こすわけではない(MICsは典型的に128‐500窮/ml)を取り除く6’アセチル基転移酵素に対する遺伝子が自然に起こる。この遺伝子のプローブは遊離したE.faeciumの種の同定に用いられてきた。さらに加えて、
E.faeciumのHLR(ゲンタマイシンに対するHLRは除いて)はアデニル酸転移酵素の為に、トブラマイシンから遊離するということが最近述べられている。それゆえ,重篤な腸球菌の伝染病における相乗作用を可能にするトブラマイシンの使用は、トブラマイシンの
HLRへのスクリーニング(一般に入手可能なテストではない)によって種の同定と同じように、実際的に両方が重視される必要がある。最近、獣医学やヒトのゲンタマイシンの中程度レベル
(256窮/ml)への遊離的抵抗性は、aph(2”)‐Icに指示された遺伝子によって読みこまれた新しいゲンタマイシン修飾酵素に基づいている。この遺伝子はゲンタマイシンと細胞壁に活動的な動因への相乗作用に対する抵抗性を与え、二機能性酵素を産出する種よりももっと容易に発見できるかもしれない。
ペニシリン抵抗性を取り入れたβ―ラクタマーゼ―非β―ラクタマーゼ
まず始めに、単離した腸球菌を産出するぺニシリナーゼは、
E.faecalisを単離したもので、1981年に、ヒューストンとテキサスの回復した患者から見つかった。まれではあるが、これらの遊離は合衆国(テキサス、フロリダ、ノースカロライナ、デラウェア、ペンシルベニア、ニューヨーク、マサチューセッツ、コネチカット)レバノン、カナダ、そしてアルゼンチンで報告されている。
他の腸球菌のように、コロニー形成因としてみなされている種の産出をするβ―ラクタマーゼはボストン子供病院でコロニー形成の大きな
”激増”とみなされているが、バージニア・ベテランス投与病院や、アルゼンチンから隔離された場所や、他の報告によって示されているようにそれらは、真の伝染病と関係している。腸球菌のぺニシリナーゼ遺伝子はブドウ球菌性
A型ぺニシリナーゼを組み込んだ遺伝子と同一で,ゲンタマイシンへのHLR種に通常起こり,しばしばaph(2”)-Ia/aac(6”)-Ieを含む伝達性プラスミドにみられる。相対的に低いレベルのβ―ラクタマーゼは、腸球菌によって、これらの種との種菌効果を顕著に生み出す
.ので、低いもしくは中程度の接種材料(103‐105CFU/ml)ではぺニシリナーゼ産出腸球菌は通常他の腸球菌と同様に抵抗性を示さないが、高い接種材料(>107CFU/ml)ではこれらの有機物は通常ペニシリンやアンピシリン、ウレイドペニシリンに高い抵抗性を示す.。ぺニシリナーゼの活性はβ―ラクタマーゼの抑制因子
clavulanate,sulbactam,tazobactamによって逆転する。心内膜炎の動物モデルにおいて、β―ラクタマーゼ抑制因子はアンピシリンやペニシリンの治療的効力を顕著に増強しているのが見られた.臨床検査室においてはぺニシリナーゼ産出腸球菌は一般に
MICsやディスク拡散といった日常的研究室のテストによっては見られない。この理由として、もしペニシリンを治療に使用したら、心内膜炎や他の重篤な伝染病の患者から遊離した腸球菌は色素生産性セファロスポリンニトロセフィンといった特異的β―ラクタマーゼを使用したテストによってぺニシリナーゼ産生をテストすべきなのである
.。非ペニシリナーゼ産出ペニシリンー抵抗性腸球菌は
10年間調査されてきて通常E.faeciumに存在している.。最近までに、ペニシリンの
MICsは典型的に8窮/mlから64窮/mlにわたり、時折単離したより高いレベルの抵抗性を持つものもある。しかしながら、ますますより高いペニシリン抵抗性レベルをもった多くの種が報告されている。
低レベルから高レベル抵抗性に変わる多くの種か、播種性のある限定された種かどうかは明らかではない。
この抵抗性を取り入れた機能は低親和性ペニシリン―結合蛋白質
(細胞壁合成酵素)を過剰産出し、ペニシリンに対するこれらの酵素の親和性はさらに低下する。なぜ多くのバンコマイシン抵抗性
E.faeciumもまたアンピシリンに対して、高い抵抗性レベルを持つかは説明ができ、米やその仲間で、ある系統から他の系統へのバンコマイシン抵抗性の伝達はアンピシリン抵抗性の伝達と連結しているように見られる。
バンコマイシン抵抗性
近年の最も驚くことはバンコマイシンに対する抵抗性を得た腸球菌の出現である
.。バンコマイシンは
1970年の後半や、特に1980年代までには多くは使用されていないが、1950年代から臨床で使用されてきた。というのは、複数の遺伝子が 、バンコマイシン抵抗性の発生(抵抗性の発生は、容易でもなく最近のものでもない)を含んでいるからである。バンコマイシンの3種の表現型(
typeA,B,C)は今日よく表現されているが、第4のD型は最近報告された。VanA
型系統は典型的にバンコマイシンに高度な抵抗性を、テイコプラニンに中程度もしくは高度の抵抗性を示す。この表現型はしばしばプラスミドもしくは伝達トランスポゾンで、誘導性である(すなわち、バンコマイシンの細菌への露出が、互いに抵抗性を与えるいくつかのタンパク質の合成を誘導する。)
バンコマイシン感受性腸球菌において、
D-アラニル-D-アラニン(内在性D-アラニン-D-アラニン連結酵素からなる)は、ペンタペプチド前駆物質からトリペプチド前駆物質へ加えられている。D-
アラニン-D-アラニン終端はバンコマイシンの標的である。一度バンコマイシンは結合すると、ペンタペプチド前駆物質の細胞壁合成への使用は阻害される。VanA
表現型において、バンコマイシンへの細菌性細胞の露出によって合成を誘発されるタンパク質の一つがVanAと呼ばれていて、VanAは連結酵素であり、バンコマイシン感受性腸球菌を含む大腸菌や他の生態からのD-アラニン-D-アラニン連結酵素と似ている。VanA
はD-アラニン-D-X(Xは通常乳酸)を発生させる。D-乳酸の形成はVanHの存在の為であり、VanHによって脱水素酵素が取り込まれる。D-
アラニン-D-Lacといったデプシペプチド部分はデプシペンタペプタイド前駆物質に起因するトリペプチド前駆物質である。バンコマイシンは
D-アラニン-D-Lac終端に結合しないので、このデプシペンタペプタイドは細胞壁合成の存続する段階において使用される。しかしながら、
D-アラニン-D-アラニンにおいて正常なペンタペプチド前駆物質終末もまた存在するとき、前駆物質を含むD-アラニン-D-Lacの存在をにもかかわらず、細胞は完全なバンコマイシン抵抗性ではなくなる。この明らかな問題は
D-アラニン-D-アラニンを切断し、トリペプチド前駆物質への添加を防ぐ、ジペプチターゼ、VanXを取り込んだVanXによって大部分が処理される。もし正常なペンタペプチド前駆物質において、いくつかの
D-アラニン-D-アラニンが切断から免れると、結果的に、VanYが付属的なもしくはバックアップ機能を取り込む。