丂
丂僒儖儌僱儔偺旕怘忋旂嵶朎傊偺怤擖偼昦尨搰 (SPI1:Salmonella pathogenicity island 1)偵
廤傑傞堚揱愼怓懱傪昁梫偲偟偰偄傞丅EPEC偺條偵SPI1偼僞僀僾3暘斿僔僗僥儉傗暘斿暔偺撆
惈梫慺傪僐乕僪偡傞丅僞僀僾3暘斿僔僗僥儉偼廻庡嵶朎偺僶僋僥儕傾偺庢傝偙傒偵塭嬁偡傞晹
埵偵愙怗偟丄廻庡嵶朎偵捈愙撆慺傪拲擖偡傞栶栚傪偟偰偄傞丅嬤擭丄SPI1偱僐乕僪偝傟傞僶僋
僥儕傾僞儞僷僋SptP偼僠儘僔儞僼僅僗僼傽僞乕僛偺嶌梡偱傾僋僠儞傪挷愡偡傞廻庡嵶朎偺崪奿
廻庡忋旂嵶朎偵攝抲偝傟傞偙偲偑抦傜傟偰偒偨丅怗攠椞堟偵偁傞SptP僔僗偺巆懚偺暘楐偼
僼僅僗僼傽僞乕僛偺嶌梡傪幐傢偣傞寢壥偲側傞丅偦偙偱丄SptP偼廻庡偺傾僋僠儞慇堐偺暘楐偵
嶌梡偟枌桝憲傗偦傟偵敽偭偰婲偙傞僶僋僥儕傾偺庢傝偙傒傪懀恑偡傞偲壖愢偝傟偨丅
丂僶僋僥儕僆僼傽乕僕偼僒儖儌僱儔嬠偺愼怓懱撪偵尒傜傟傞丅嵟嬤丄撆惈偺場巕偑偙偺僎僲儉
撪偵僐乕僪壔偝傟丄偙偺撆惈場巕SopE偼嵶嬠偑岠棪揑偵廻庡嵶朎傊怤擖偡傞偺偵昁梫偱偁
傞偲偄偆偙偲偑徹柧偝傟偨丅SopE偼僞僀僾俁偺暘斿婡峔傪昁梫偲偡傞丅偦傟偼丄廻庡嵶朎傊擖
傝崬傓偨傔偱偁傝丄廻庡嵶朎偵偍偄偰丄SopE偼捈愙傾僋僠儞嵶朎崪奿偺攝楍曄姺傪婲偙偝偣
傞丅偦傟偼彫偝側GTPase偺Rho垷壢偺傂偲偮偱偁傞僌傾僯僕儞岎姺場巕偲偟偰嶌梡偡傞丅
SopE撍慠曄堎偼栰惗宆傛傝傕忋旂嵶朎傊偺怤擖偵偍偗傞傾僋僠儞嵶朎崪奿偺攝楍曄姺傪偡
傞偙偲偑偱偒側偄丅偙偺敪尒偼昦尨懱偑偳偺傛偆偵嵶朎撪偱廻庡嵶朎偺抈敀偵帡偨傕偺傪巊
偭偰廻庡帺恎偺怣崋婡峔傪攋夡偡傞偺偐傪柧傜偐偵偡傞丅
丂
丂
廻庡偺場巕偼僒儖儌僱儔偺怤擖偵怺偔娭傢偭偰偄傞
丂僒儖儌僱儔偺怤擖拞偵丄廻庡偺戝偒側嵶朎崪奿峔惉夵曄偼偨偔偝傫偺廻庡偺場巕傪昁梫偲
偡傞丅Rho垷壢偺傂偲偮丄Cdc42偼枌傪側傒偩偨偣傞偙偲偵傛偭偰嵶嬠偺媧拝傪揱偊傞昁梫偑
偁傞丅SopE偺僌傾僯僕儞岎姺妶惈偼廻庡偵偍偗傞Cdc42偺巋寖傪巌傞偲巚傢傟偰偄傞丅昦尨
懱偼丄傑偨嵶嬠偺愙怗偵偍偄偰廻庡PLC乮Phospholipase C乯傪妶惈壔偟丄偝傜偵怣崋傪憲傞俀
師儊僢僙儞僕儍乕偺嶻惗傪堷偒婲偙偡丅寢壥偲偟偰廻庡嵶朎偺Ca2亄擹搙偑曄壔偡傞丅偙傟偼
僒儖儌僱儔偺怤擖偵偍偄偰嵶朎崪奿偺攝楍曄姺偺偒偭偐偗偲側傞丅EPEC偲僒儖儌僱儔偼偄偔
偮偐偺摨偠怣崋峔憿乮PLC,Ca2亄丄Fluxes乯傪巊偆偗傟偳傕丄偦傟偧傟偺昦尨嬠偵傛傞嵶朎崪
奿曄姺偼偦傟偧傟偺昦尨嬠偺廻庡嵶朎偑慡偔堎側傞偙偲傪桿敪偡傞丅怤擖偵怺偔偐偐傢傞偄
偔偮偐偺嵶朎崪奿峔憿偼摨堦偱偁傞偲擣傔傜傟偰偄傞丅偙傟傜偼兛乗actinin丄僩儘億儈僆僔儞丄
ezrin丄偦偟偰talin傪娷傓丅僒儖儌僱儔偺怤擖偵偍偗傞偙傟傜偺抈敀偺摿暿側栶妱偼柧傜偐偱
偼側偄丅

恾 僒儖儌僱儔嬠
丂
恾A 枌傪攇棫偨偣傞僒儖儌僱儔嬠偺揹尠幨恀
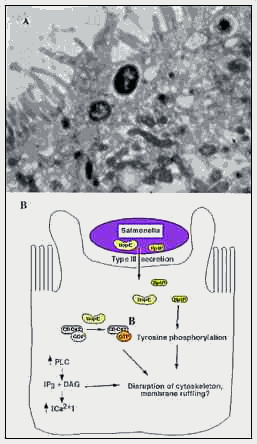
恾B 廻庡忋旂嵶朎傊偺僒儖儌僱儔嬠偺怤擖
丂僒儖儌僱儔嬠偼嘨宆偺暘斿婡峔偵傛偭偰SopE偲SptP傪娷傓撆惈偺抈敀傪廻庡嵶朎傊暘斿
偡傞丅SopE偼彫偝側GTP愙崌抈敀偺偨傔偵僌傾僯僕儞岎姺場巕偲偟偰婡擻偟丄偍偦傜偔Rho垷
壢偺CDC42偵偍偄偰GDP偲GTP偺岎姺傪拠夘偡傞丅SptP偼怤擖乮嵶朎崪奿傪暘楐偝偣傞乯偺
偨傔偵昁梫側僠儘僔儞儂僗僼傽僞乕僛偱偁傞丅怤擖偼傑偨丄儂僗儂儕僷乕僛C傪妶惈壔偝偣丄僀
僲僔僩乕儖嶰儕儞巁墫偲Ca2亄梟夝傪堷偒婲偙偡丅偦偙偱偼丄師偵嵶朎崪奿偺暲傋懼偊偑偍偙
傝丄枌偺攇棫偪偑婲偙傝丄僒儖儌僱儔嬠偑撪懁偵怤擖偡傞丅
丂
丂
丂